e-ISSN: 2215-3896.
(Julio-Diciembre, 2023). Vol 57(2)
DOI: https://doi.org/10.15359/rca.57-2.9
Open Acces: www.revistas.una.ac.cr/ambientales
e-Mail: revista.ambientales@una.cr
Licencia: CC BY NC SA 4.0
Cambios en la estructura vertical y composición florística en la Reserva Natural Madre Verde
—Costa Rica— tras 15 años de restauración ecológica
Changes in the vertical structure and floristic composition in the Madre Verde Natural Reserve —Costa Rica— after 15 years of ecological restoration
Cindy Rodríguez-Arias1
[Recibido: 22 de septiembre 2022, Aceptado: 24 de marzo 2023, Corregido: 1 de mayo 2023,
Publicado: 22 de mayo 2023]
Resumen
[Introducción]: La restauración ecológica es una prioridad global para recuperar la biodiversidad y alcanzar los Objetivos de Desarrollo Sostenible. Desde su creación en el año 2000, la Reserva Natural Madre Verde en Costa Rica ha sido un modelo en este sentido. En 2005 se realizó una caracterización de las comunidades vegetales presentes: pastizal, charral, cultivo abandonado, área dominada por burío, bosque secundario denso, bosque secundario ralo y dos remanentes de bosque maduro. [Objetivo]: En 2020 se repitió el estudio, excluyendo los remanentes de bosque maduro, con el fin de evaluar los cambios en la vegetación después de 15 años de restauración. [Metodología]: Se identificaron las especies de árboles, se calcularon índices de riqueza y diversidad y se elaboraron perfiles de vegetación en cada tipo de comunidad. [Resultados]: Los mayores cambios en los índices de riqueza y diversidad, composición y estructura vertical de la vegetación se observaron en las zonas de pastizal que fueron sometidas a reforestación activa. Además, se registraron cambios importantes en el charral y en la zona dominada por burío. Los menores cambios se dieron donde ya existía algún tipo de bosque secundario relativamente maduro debido a la sombra creada por los árboles. [Conclusiones]: En todos los sitios predominan las especies pioneras nativas de esta zona de vida, lo que garantiza el proceso natural de regeneración. Estos resultados permiten conocer los avances en la restauración y saber cuáles son las especies más adecuadas para reforestar otras áreas similares y asegurar la recuperación del bosque secundario de manera más rápida y efectiva.
Palabras clave: Costa Rica; reforestación; regeneración; sucesión; vegetación.
Abstract
[Introduction]: Ecological restoration is a global priority for recovering biodiversity and achieving Sustainable Development Goals. Since its creation in 2000, the Madre Verde Natural Reserve in Costa Rica has been a model in this regard. In 2005, a characterization of the present vegetation communities was conducted, including grassland, shrubland, abandoned crop, area dominated by burío, dense secondary forest, sparse secondary forest, and two remnants of mature forest. [Objective]: In 2020, the study was repeated, excluding the remnants of mature forest, to evaluate changes in vegetation after 15 years of restoration. [Methodology]: Tree species were identified, richness and diversity indices were calculated, and vegetation profiles were developed for each community type. [Results]: The greatest changes in vegetation richness and diversity indices, composition, and vertical structure were observed in grassland areas that underwent active reforestation. Additionally, significant changes were recorded in shrubland, and the area dominated by burío. The least changes were observed where some type of relatively mature secondary forest already existed due to the shade created by the trees. [Conclusions]: Pioneering native species from this life zone predominate in all sites, ensuring the natural regeneration process. These results allow us to know the advances in restoration and which species are most suitable for reforesting other similar areas and ensuring the recovery of secondary forest more quickly and effectively.
Keywords: Costa Rica; reforestation; regeneration; succession; vegetation.
La restauración ecológica (RE) es un proceso inducido por el ser humano para recuperar las condiciones ambientales de un ecosistema perturbado, cuya meta final no siempre es recuperar de forma integral el estado del ecosistema anterior a su degradación o destrucción, pero sí garantizar las funciones de los procesos ecológicos a través del tiempo, incluyendo la recuperación de hábitats para la biodiversidad y la provisión de bienes y servicios ecosistémicos (Bonilla, 2018) mediante la rehabilitación ecológica. Su importancia en el contexto actual mundial es tal que la Asamblea General de las Naciones Unidas declaró al periodo 2021-2030 como el Decenio sobre la Restauración de los Ecosistemas, con el objetivo de prevenir, detener y revertir su degradación a nivel mundial y de alcanzar los Objetivos de Desarrollo Sostenible (ODS) relativos al cambio climático, la erradicación de la pobreza, la seguridad alimentaria, el manejo del recurso hídrico y la conservación de la diversidad biológica (Delgado-Rodríguez et al., 2021).
Por lo tanto, las iniciativas de RE están adquiriendo cada vez mayor relevancia para revertir los efectos negativos de las acciones humanas, y por eso se necesitan herramientas para comprender y cuantificar sus avances y guiar los esfuerzos para tener un mayor éxito con los limitados recursos que se destinan a estas actividades (Duarte et al., 2017). Esto es de particular importancia en América Latina, donde muchos ecosistemas han sido degradados significativamente, lo que amenaza el bienestar de la región, su potencial para un futuro sostenible y su capacidad para adaptarse y mitigar el cambio climático (Zhongming et al., 2021).
El bosque húmedo premontano es el tipo de bosque que ha sufrido la mayor alteración y reducción en Costa Rica, como lo demuestran varios estudios (Amador, 2003; Bonilla, 2018; Cascante y Estrada, 2001; Rodríguez y Brenes, 2009). Esta situación se agrava en el Valle Central, donde se concentra la mayoría de la población y las condiciones climáticas favorecen la agricultura y el desarrollo urbano (Bonilla, 2018).
En la región de Occidente de este valle se ha llevado a cabo un esfuerzo notable de restauración de este tipo de bosque, a través de la creación de la Reserva Natural Madre Verde (RNMV) en el 2000. En el período comprendido entre 2005 y 2006, la autora del presente estudio caracterizó los 8 tipos de comunidades vegetales presentes en la reserva (Rodríguez, 2007). Para esto se realizaron perfiles de bosque y se calcularon índices de riqueza y diversidad de especies para cada uno de los 8 tipos de vegetación, que incluyeron pastizal, charral (fase inicial de la sucesión secundaria), cultivo abandonado, área dominada por burío (Heliocarpus appendiculatus), bosque secundario denso, bosque secundario ralo y dos remanentes de bosque maduro (Rodríguez, 2007).
Después de la investigación mencionada, los encargados de la RNMV han llevado a cabo distintas estrategias para restauración del bosque, que han incluido la reforestación con participación de las comunidades en algunos sectores de la reserva y la regeneración natural en otros. Por lo tanto, existía un gran interés por conocer cuál ha sido el impacto de estos esfuerzos en la recuperación del bosque y en la biodiversidad local (P. Campos, comunicación personal, 3 de setiembre, 2019).
Además, el conocimiento adquirido al estudiar la RE en una región en particular es fundamental para conocer los patrones sucesionales de la vegetación que pueden tener importantes implicaciones prácticas en otros proyectos similares. Por ejemplo, el estudio de la estructura de la vegetación y del recambio de especies pueden ser cruciales para la selección de especies potenciales para reforestación (Avella et al., 2019). También se debe considerar que un estudio de monitoreo puede requerir varios años, e incluso décadas, para demostrar que el ecosistema asistido ha recuperado la trayectoria sucesional deseada, por lo que debe incluirse en todo proyecto de restauración para evitar correr el riesgo de invertir mal los recursos o jamás conocer los resultados de las acciones emprendidas (Díaz-Triana et al., 2019).
Por lo tanto, el objetivo de esta investigación fue evaluar los cambios en la estructura de las comunidades vegetales en la RNMV durante un periodo de 15 años para conocer el impacto de las diferentes acciones de restauración ecológica llevadas a cabo en el lugar. Los resultados aquí expuestos servirán a los administradores de la reserva para evaluar los esfuerzos de conservación implementados hasta el momento y tomar decisiones de manejo basadas en criterios científicos en el futuro. Además, la información puede ser útil para aquellos que realicen esfuerzos de recuperación del bosque similares en la región del Valle Central y en el bosque premontano.
La RNMV pertenece a la Fundación Madre Verde (FMV), organización no gubernamental y sin fines de lucro. Se ubica en Costa Rica, en la provincia de Alajuela, cantón de Palmares, 1 km al oeste y 500 m al suroeste de la plaza de deportes del distrito de La Granja, entre las coordenadas geográficas 84º27’10’’ y 84º27’50`` longitud oeste y 10º2’30`` y 10º3’30`` latitud norte (ver Figura 1) y en la zona de vida de bosque húmedo y muy húmedo premontano. Tiene una extensión de 31 ha, donde anteriormente existía una lechería y cafetales y permanecen dos remanentes de bosque; actualmente se encuentra en proceso de restauración ecológica. Su topografía va de ondulada a escarpada, con pendientes mayores al 60 % (Rodríguez, 2007).
En el 2005, la RNMV contaba con ocho tipos de comunidades vegetales. En la Figura 1 se puede apreciar la cobertura vegetal de aquel entonces y la distribución y extensión de cada tipo de comunidad vegetal. Los mayores porcentajes correspondían a potrero y charral, con un 25 y un 26 % respectivamente, debido a que esta reserva era una finca dedicada a la agricultura y ganadería antes de ser adquirida por la Fundación en el 2000. Sin embargo, 25 % estaba cubierto de bosques secundarios, y los menores porcentajes correspondían a dos parches de bosque remanente, con apenas un 5 % del territorio. Además, dada su importancia como núcleos de regeneración y corredores para el movimiento de la fauna, se destacaron en el mapa las cercas vivas presentes en el potrero y en el charral, así como la franja de vegetación que protege la quebrada.
Con el fin de evaluar los cambios en la vegetación se ubicaron los sitios en los cuales se realizaron los estudios en el 2005 (Figura 1), que en aquel entonces correspondían a 1) pastizal, 2) charral, 3) área dominada por burío (también denominada “bureal”), 4) cultivo abandonado, 5) bosque secundario ralo, y 6) bosque secundario denso, para realizar un muestreo estratificado. No se evaluaron los remanentes de bosque maduro ni zona de protección de la quebrada y cercas vivas, puesto que lo que se busca es evaluar cómo se regenera la vegetación. Seguidamente se consultó a miembros de la FMV cuáles han sido las estrategias de restauración aplicadas en cada uno de los ecosistemas.
Además, se incluyeron dos nuevas zonas (identificadas como áreas de reforestación 1 y 2) que en el 2005 estaban cubiertas totalmente por pastos, principalmente estrella africana y jaragua y algunos arbustos, razón por la cual fueron seleccionadas como sitios prioritarios para llevar a cabo las campañas de reforestación a cargo de la FMV que se llevaron a cabo entre 2001 y 2008.
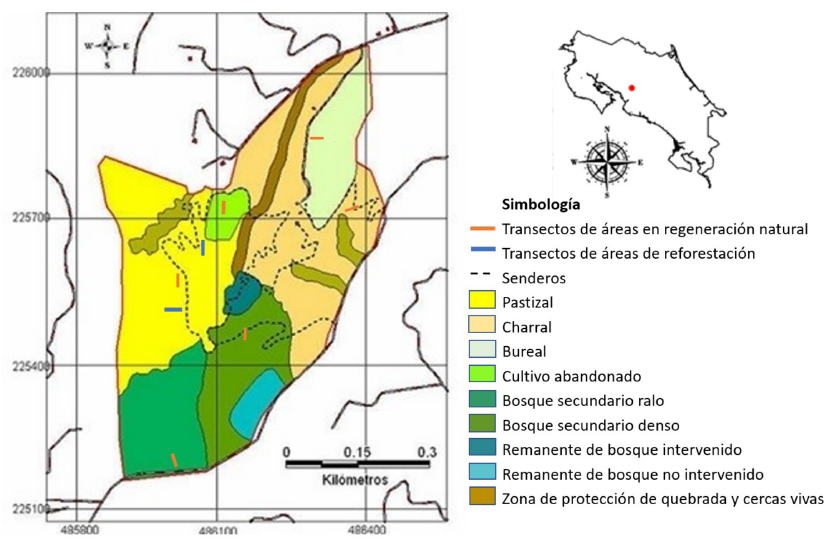
Figura 1: Ubicación de la Reserva Natural Madre Verde y su uso del suelo en el 2005 (modificado de Rodríguez, 2007).
Figure 1: Location of the Madre Verde Natural Reserve and its land use in 2005 (modified from Rodríguez, 2007).
Para evaluar los cambios en la vegetación desde el 2005 al 2020, se siguió la misma metodología utilizada en la primera investigación. Para una descripción de la composición florística en cada comunidad vegetal se delimitó un transecto de 50 x 10 m, y se registraron las especies arbóreas presentes con un diámetro a la altura del pecho (DAP) superior a 10 cm y las arbustivas con diámetro a la altura de la base (DAB) superior a 10 cm. Con esto se registró el número de individuos y se calculó la riqueza de especies, el índice de diversidad y el coeficiente de Sorensen (Smith y Smith, 2007), que en este caso mide qué tan similares son las especies encontradas en el 2005 y en el 2020, siendo 0=totalmente diferente y 1=igual, sin cambios.
Para obtener una descripción de la estructura vertical de cada comunidad vegetal, se elaboraron perfiles de vegetación con este procedimiento: se establecieron tres transectos de 10 x 5 metros en cada sitio de estudio; en cada transecto se registraron datos de cada especie, incluyendo su diámetro a la altura del pecho, altura, distribución espacial y forma de la copa. Se consideraron individuos con un diámetro a la altura del pecho de 10 a 19.9 cm en el primer transecto, de 20 a 29.9 cm en el segundo, y mayores a 30 cm en el tercero. Posteriormente, se representó gráficamente la información obtenida para integrar los datos de los tres transectos en un solo dibujo para cada tipo de vegetación (perfil).
Los resultados obtenidos se contrastaron con los del 2005 (Rodríguez, 2007) para poder evaluar la recuperación vegetal en cada uno de los sitios estudiados.
3.1 Cambios en la cobertura del suelo
Para el 2020, la mayor parte de la RNMV (a excepción de las zonas verdes alrededor de la infraestructura) se encuentra totalmente cubierta de bosque, ya sean los remanentes de bosque maduro que existían desde su creación, o bosques secundarios producto de los procesos de restauración pasiva y activa que se han estado llevando a cabo.
La zona que fue sometida a restauración activa mediante diferentes campañas de reforestación y control de pastos organizadas por la FMV entre los años 2005 y 2008 (G. Araya, comunicación personal, 27 de mayo, 2021) corresponde al área delimitada como “pastizal” (color amarillo) en la Figura 1. El resto de la RNMV se mantuvo en regeneración natural sin ningún tipo de intervención.
3.2 Cambios en la composición de especies de las comunidades vegetales
Todas las comunidades vegetales (a excepción de los remanentes de bosque maduro, no tomados en cuenta en este estudio) han pasado a ser bosque secundario en diferentes etapas de sucesión; sin embargo, para una mejor comprensión se mantiene el nombre que se utilizó en el 2005 para cada sitio estudiado.
El número total de especies de árboles encontradas en la totalidad de los sitios, en ambos años, es 49, correspondientes a 28 familias, de las cuales Fabaceae es la que tienen la mayor cantidad de representantes. En el Cuadro 1 se ofrece la lista de especies de árboles y arbustos encontradas en los transectos de cada sitio en ambos estudios (2005 y 2020).
Cuadro 1. Especies presentes en cada comunidad vegetal en la RNMV (P = pastizal; C = charral, B = bureal; CA = cultivo abandonado; BSR = bosque secundario ralo; BSD = bosque secundario denso; 20 = encontrada en el 2020; 05 = encontrada en el 2005).
Table 1. Species present in each plant community in the MVRN (P = grassland; C = scrubland, B = bureal; CA = abandoned crop; BSR = sparse secondary forest; BSD = dense secondary forest; 20 = found in 2020, 05 = found in 2005).
|
Especie |
P |
C |
B |
CA |
BSR |
BSD |
|
Acalypha benensis Britton |
05 |
|||||
|
Aiouea montana (Sw.) R.Rohde |
20 |
05/20 |
||||
|
Alsophila polystichoides Christ |
20 |
|||||
|
Annona cherimola Mill. |
05 |
|||||
|
Arachnothryx buddleioides (Benth.) Planch. |
05 |
|||||
|
Blakea anomala Donn.Sm. |
05 |
|||||
|
Blakea gracilis Hemsl. |
05 |
|||||
|
Cecropia obtusifolia Bertol. |
20 |
05/20 |
20 |
20 |
20 |
|
|
Cedrela odorata L. |
20 |
20 |
||||
|
Cestrum schlechtendalii G.Don |
20 |
20 |
||||
|
Clethra mexicana DC. |
20 |
05 |
||||
|
Clusia croatii D’Arcy |
05 |
|||||
|
Coffea arabica L.* |
05 |
05 |
||||
|
Cojoba costaricensis Britton & Rose |
05/20 |
|||||
|
Conostegia xalapensis D.Don |
05/20 |
20 |
20 |
05 |
05/20 |
|
|
Cordia eriostigma Pittier |
20 |
|||||
|
Croton draco Schltdl. |
20 |
05 |
05/20 |
05/20 |
05 |
|
|
Croton sp. |
20 |
|||||
|
Cupania glabra Sw. |
20 |
|||||
|
Dracaena fragrans (L.) Ker Gawl.* |
05 |
|||||
|
Erythrina poeppigiana (Walp.) O.F. Cook* |
20 |
|||||
|
Ficus americana Aubl. |
20 |
|||||
|
Ficus aurea Nutt. |
05/20 |
05/20 |
||||
|
Ficus citrifolia Mill. |
20 |
|||||
|
Ficus pertusa L.f. |
20 |
05/20 |
||||
|
Ficus velutina Humb. & Bonpl. ex Willd. |
20 |
|||||
|
Heliocarpus appendiculatus Turcz. |
05/20 |
05/20 |
05/20 |
05/20 |
20 |
05/20 |
|
Inga densiflora Benth. |
05/20 |
20 |
||||
|
Inga punctata Willd. |
05 |
|||||
|
Iochroma arborescens (L.) J.M.H. Shaw |
20 |
|||||
|
Lasianthaea fruticosa (L.) K.M. Becker |
20 |
20 |
05/20 |
05 |
05 |
05/20 |
|
Lonchocarpus oliganthus F.J. Herm. |
20 |
20 |
||||
|
Malvaviscus penduliflorus DC. |
20 |
|||||
|
Mollinedia costaricensis Donn. Sm. |
20 |
|||||
|
Musa sp* |
05/20 |
|||||
|
Myrica cerifera L. |
05 |
|||||
|
Myrsine coriacea (Sw.) R. Br. ex Roem. & Schult. |
20 |
20 |
20 |
20 |
05/20 |
|
|
Ocotea veraguensis (Meisn.) Mez |
05 |
|||||
|
Palicourea guianensis Aubl. |
05 |
|||||
|
Psidium guajava L. |
20 |
20 |
05 |
05/20 |
||
|
Robinsonella lindeniana (Turcz.) Rose & Baker f. |
20 |
20 |
05/20 |
05/20 |
20 |
20 |
|
Roystonea regia O.F. Cook* |
20 |
|||||
|
Sapium glandulosum (L.) Morong |
20 |
20 |
05 |
20 |
05/20 |
|
|
Senna papillosa (Britton & Rose) H.S. Irwin & Barneby |
20 |
20 |
20 |
05/20 |
05/20 |
|
|
Spathodea campanulata Buch.-Ham. ex DC.* |
20 |
|||||
|
Tabernaemontana litoralis Kunth |
20 |
|||||
|
Vismia baccifera (L.) Planch. & Triana |
20 |
|||||
|
Xylosma intermedia (Seem.) Triana & Planch. |
20 |
|||||
|
Zygia longifolia (Humb. & Bonpl. ex Willd.) Britton & Rose |
20 |
|||||
|
Total de especies |
16 |
16 |
19 |
11 |
20 |
18 |
* Especies exóticas o introducidas
En cuanto a los cambios en la composición de las especies en cada sitio, según el coeficiente de similitud de Sorensen, el sitio que tuvo un mayor cambio en la composición de especies fue el pastizal (QS = 0.11), seguido por el charral (QS = 0.24), el bosque secundario ralo (QS = 0.26) y el bureal (QS = 0.36). Por su parte, los que mantienen una mayor similitud en su composición de especies son el cultivo abandonado (QS = 0.63) y el bosque secundario denso (QS = 0.66).
Con respecto a las diferencias cuantitativas, como se observa en la Figura 2, prácticamente en todos los sitios se dieron cambios en el número de árboles y en la riqueza de especies. El mayor aumento en ambos parámetros se dio en el pastizal y, en menor grado, en el charral y el bureal, mientras que en los demás sitios disminuyeron o se mantuvieron. El índice de diversidad de Shannon aumentó en el pastizal, charral y bureal, mientras que en los demás sitios disminuyó levemente.
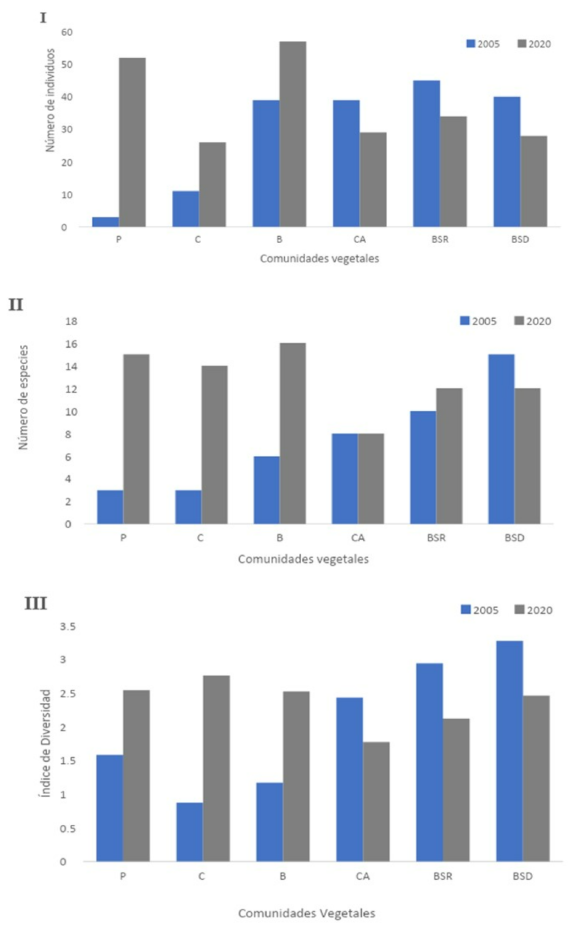
Figura 2. Cambios en I: el número de árboles (individuos); II: el número de especies; III: el índice de diversidad de Shannon en cada comunidad vegetal. (P = pastizal; C = charral, B = área dominada por burío; CA = cultivo abandonado; BSR = bosque secundario incipiente; BSD = bosque secundario denso).
Figure 2. Change in I: the number of trees (individuals); II: the number of species; III: the Shannon diversity index in each plant community. (P = pasture; C = scrubland, B = area dominated by burío; CA = abandoned crop; BSR = sparse secondary forest; BSD = dense secondary forest).
3.3 Cambios en la estructura vertical de la vegetación
Los siguientes perfiles de vegetación permiten distinguir cambios en la altura, composición y densidad de la vegetación. Para cada sitio la figura superior corresponde a la realizada en el 2005 y la inferior en 2020.
En la Figura 3 se muestran los perfiles de la vegetación en este sitio, que en el 2005 ocupaba un área de 7.79 ha (25 % del total de la reserva) (Figura 1).

Figura 3: Perfil de la vegetación del antiguo pastizal*
Figure 3: Vegetation profile of the former grassland*
*Simbología/Symbology: H. a. = Heliocarpus appendiculatus; C. x.= Conostegia xalapensis; L. f. = Lasianthaea fruticosa; M. c. = Myrsine coriacea; S. g. = Sapium glandulosum; S. p. = Senna papilosa; F. j. = Ficus aurea.
En el 2005 este sitio estaba dominado por pastos de varias especies, principalmente Hypharrenia rufa y Cynodon nlemfuensis. También eran abundantes varias especies herbáceas y arbustivas, principalmente Baccharis trinervis y Calea urticifolia. Algunos árboles aislados de la especie Ficus aurea servían como como núcleos de regeneración, ya que bajo su sombra se empezaban a establecer otras especies arbóreas y arbustivas, principalmente H. appendiculatus y C. xalapensis, especies pioneras que al mismo tiempo favorecen la regeneración natural al crear sombra que elimina la competencia de los pastos. Después de 15 años es notable el efecto de este árbol núcleo en el aumento en la densidad de dichas especies.
Al 2020 esta zona se ha convertido en un bosque secundario joven gracias a dichos árboles que sirvieron como núcleos de regeneración y a la labor reforestadora emprendida por la FMV entre 2000 y 2008. Con el fin de destacar el impacto de esta restauración activa, se decidió hacer dos nuevos perfiles de vegetación en áreas que durante el 2005 solamente tenían pastos y algunos arbustos, y que se describen más adelante.
En el 2005 esta comunidad vegetal cubría el 26 % de la reserva (ver la Figura 1). Era muy heterogénea, y en ella las especies arbóreas y arbustivas tendían hacia una distribución agregada. Las que se encontraban con mayor frecuencia eran H. appendiculatus, C. obtusifolia y otras especies pioneras típicas de las primeras etapas sucesionales. La Figura 4 muestra el perfil de esta comunidad vegetal donde predominaba la H. appendiculatus, acompañada de un estrato herbáceo bastante alto y arbustos de porte pequeño.
Para el 2020, y debido a la regeneración natural, este fue uno de los sitios con un mayor cambio en la estructura vertical de la vegetación, superando los 20 metros de altura y estableciendo un subdosel, un sotobosque y un estrato arbustivo y arbóreo bien definidos. Además, los pastos altos se eliminaron y fueron reemplazados por vegetación típica del estrato herbáceo, como heliconias, marantáceas, helechos y aráceas.

Figura 4: Perfiles de la vegetación del charral*
Figure 4: Vegetation profiles of the scrubland*
*Simbología/Symbology: H. a. = Heliocarpus appendiculatus; C. o. = Cecropia obtusifolia; M. c. = Myrsine coriacea; C. o. = Cedrella odorata; P. g. = Psidium guajava; L. f. = Lasianthaea fruticosa; S. p. = Senna papillosa; R. l. = Robinsonella lindeniana.
3.3.3 Área dominada por burío (bureal)
Esta comunidad vegetal cubría un 10 % del total de la reserva (ver la Figura 1). En el pasado estuvo cultivada de café, combinado con algunos árboles de poró, limón, mango, anona, plantas de banano y caña india, que aún se pueden observar en el sitio. En el estudio anterior era un área muy homogénea, tal como se puede apreciar en la Figura 5, y con un índice de diversidad muy bajo (H= 1.17). La especie dominante era H. appendiculatus, conocida como “burío” (de ahí que al sembradío se le llame también “bureal”), la cual había generado un dosel continuo cuya sombra había permitido el control de hierbas y el establecimiento de plántulas de algunas pocas especies arbóreas.
Para el 2020, tras un proceso de regeneración natural, el cambio en la estructura y composición fue significativo. Muchos de los buríos se encuentran ya caídos y dieron paso a nuevas especies como guarumos, achiotillos, cedros amargos, ratoncillos, entre otros; proceso natural en estos primeros estadios de sucesión ecológica.
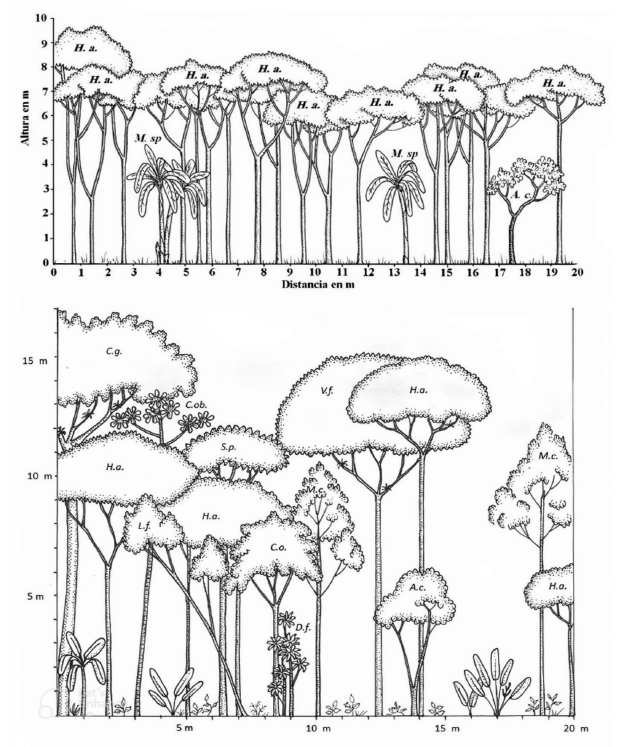
Figura 5: Perfil de la vegetación del área dominada por burío (bureal)*
Figure 5: Vegetation profile of the area dominated by burío (bureal)*
*Simbología/Symbology: H. a. = Heliocarpus appendiculatus; A. c. = Annona cherimola; M. sp. = Musa sp; C. g. = Cupannia glabra; C. ob. = Cecropia obtusifolia; L. f. = Lasianthaea fruticosa; S. p.= Senna papillosa; C. o. = Cedrella odorata; M. c. = Myrsine coriacea; V. f. = Vismia baccifera; A. c. = Annona cherimola.
3.3.4 Área de cultivo abandonado
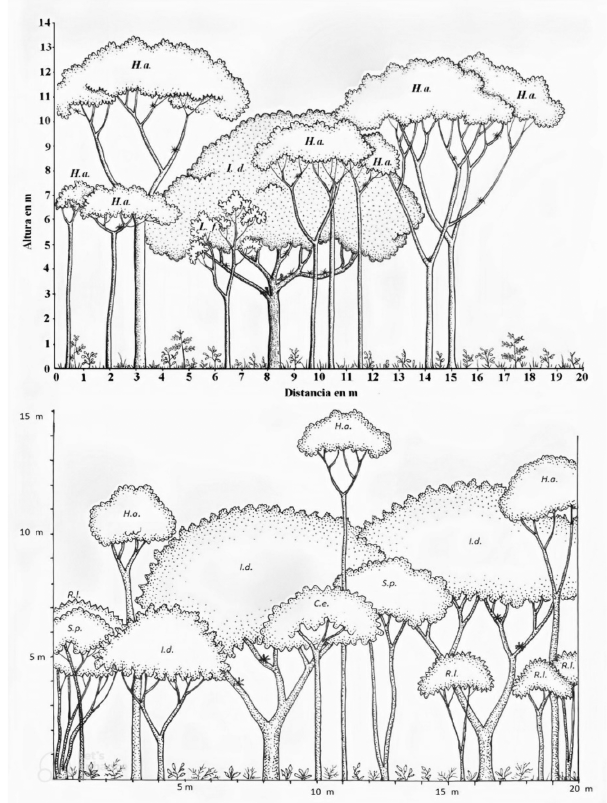
Figura 6: Perfil de la vegetación del cultivo abandonado*
Figure 6: Profile of the vegetation of the abandoned crop*
*Simbología/Symbology: I. d. = Inga densiflora; H. a. = Heliocarpus appendiculatus; L. f. = Lasianthaea fruticosa; S. p. = Senna papillosa; R. l. = Robinsonella lindeniana; C. e. = Cordia eriostigma.
Esta es un área de poca extensión, 2 % del total, que en el pasado albergaba un cultivo de café (ver la Figura 1). Desde el 2005 ya contaba con un dosel con un mayor número de especies y era más heterogéneo que las comunidades anteriores en cuanto a la altura que alcanzaban los árboles (Figura 6), principalmente de las especies I. densiflora y H. appendiculatus. Algunos eran árboles de sombra del antiguo cafetal, lo que favoreció que rápidamente la vegetación tuviera la apariencia de un bosque secundario. Debido a esto no se aplicó ningún tipo de restauración activa.
Después de 15 años, es una de las comunidades vegetales que mostró menor cambio en su composición y estructura vertical, a excepción de unos pocos árboles que alcanzaron mayor altura con el tiempo (las diferencias observadas en el perfil de vegetación se deben principalmente a la metodología utilizada, en la que los árboles se subdividen en transectos de diferentes DAP y, por lo tanto, árboles que no entraron en esa categoría hace 15 años ya habían crecido lo suficiente para ser incluidos en esta ocasión).
Esta comunidad vegetal ocupaba en el 2005 el 13 % de la reserva. Es un área que en algún momento formó parte del potrero, pero fue abandonada antes, por lo que la sucesión estaba más avanzada que en las otras zonas de pastizales (ver la Figura 1). Se ubica entre los 1 300 y 1 420 m s.n.m., en el punto más alto de la reserva, que es la zona más húmeda y con temperaturas más frescas, así como una fuerte pendiente. En esta zona ya existía una mayor riqueza y diversidad de especies arbóreas que en las comunidades anteriores (Figura 7).
En el estrato de árboles estaban representados C. draco, C. mexicana, M. coriacea, P. guajava, C. costaricensis, C. xalapensis y L. fruticosa, todas especies pioneras que se establecieron de forma natural conformando un bosque secundario joven, pero que aún no formaba un dosel cerrado, razón por la cual el suelo estaba cubierto por una densa vegetación herbácea y arbustiva que hacía difícil el acceso, y los árboles no tenían tanta competencia por luz.
Para el 2020, aunque el crecimiento de los árboles no fue tan marcado como en otras comunidades, el dosel se cerró y provocó una disminución en la cantidad de árboles, pastos y arbustos y en el índice de diversidad. Siguen predominando las especies pioneras, aunque algunas han sido reemplazadas por el proceso de regeneración natural.

Figura 7: Perfil de la vegetación del bosque secundario ralo*
Figure 7: Vegetation profile of the sparse secondary forest*
*Simbología/Symbology: C. d. = Croton draco; P. g. = Psidium guajava; M. c. = Myrcine coriacea; C. m. = Clethra mexicana (Sin. C. costaricensis); R. b. = Arachnothryx buddleioides; C. x. = Conostegia xalapensis; L. f. = Lasianthaea fruticosa; R. l. = Robinsonella lindeniana; I. d. = Inga densiflora; C. c. = Cojoba costaricensis.
Esta zona en 2005 ocupaba el 12 % de la superficie de la RNMV (Figura 1) y se encontraba en un estado de sucesión más avanzado que el anterior. El dosel formaba ya un techo continuo en la mayor parte de su extensión (Figura 8). Los árboles y arbustos más comunes eran H. appendiculatus, C. draco, P. guajava, C. xalapensis, L. fruticosa y S. papillosa. Para el 2020 la estructura vertical se mantiene bastante similar, con excepción de algunos árboles de burío que ya murieron y fueron sustituidos por otras especies.
Figura 8: Perfil de la vegetación del bosque secundario denso*
Figure 8: Vegetation profile of the dense secondary forest*
*Simbología/Symbology: H. a. = Heliocarpus appendiculatus; C. x. = Conostegia xalapensis; L. f. = Lasianthaea fruticosa; M. c. = Myrsine coriacea; S. g. = Sapium glandulosum; S. p. = Senna papilosa; C. d. = Croton draco; F. p. = Ficus pertusa; I. p. = Inga punctata.
La restauración activa mediante reforestación se llevó a cabo en la zona del pastizal. Los árboles sembrados durante este periodo por la FMV fueron donados por diferentes entidades como el Instituto Costarricense de Electricidad, ONG o voluntarios, procurando que fueran especies propias de la zona (Araya, 2021 con. pers.), aunque no existe un registro de las especies y número de individuos sembrados durante ese periodo. Para el 2020 se encontraron 22 especies de árboles ya establecidas pertenecientes a 13 familias, como se detalla en el Cuadro 2.
Cuadro 2. Especies encontradas en las zonas de reforestación, número de individuos, riqueza de especies e índice de diversidad.
Table 2. Species found in the reforestation areas, number of individuals, species richness and diversity index.
|
Familia - Especie |
Zona de reforestación 1 |
Zona de reforestación 2 |
|
Aiouea montana (Sw.) R. Rohde |
0 |
1 |
|
Cecropia obtusifolia Bertol. |
0 |
1 |
|
Conostegia xalapensis D. Don |
1 |
5 |
|
Croton draco Schltdl |
1 |
0 |
|
Croton niveus Jacq. |
0 |
1 |
|
Erythrina poeppigiana (Walp.) O.F. Cook * |
0 |
1 |
|
Ficus costaricana Miq. |
1 |
0 |
|
Ficus maxima Mill. |
0 |
1 |
|
Heliocarpus appendiculatus Turcz. |
10 |
2 |
|
Inga densiflora Benth. |
4 |
0 |
|
Lasianthaea fruticosa (L.) K.M. Becker |
2 |
11 |
|
Musa sp.* |
5 |
0 |
|
Musa velutina H. Wendl. & Drude* |
2 |
0 |
|
Myrsine coriacea (Sw.) R. Br. ex Roem. & Schult. |
1 |
0 |
|
Pseudobombax septenatum (Jacq.) Dugand |
1 |
0 |
|
Psidium guajava L. |
1 |
0 |
|
Robinsonella lindeniana (Turcz.) Rose & Baker f. |
1 |
0 |
|
Samanea saman (Jacq.) Merr. |
1 |
2 |
|
Senna papillosa (Britton & Rose) H.S. Irwin & Barneby |
1 |
0 |
|
Spondias purpurea L. |
1 |
0 |
|
Trichilia hirta L. |
3 |
1 |
|
Zygia longifolia (Humb. & Bonpl. Ex Willd.) Britton & Rose |
5 |
17 |
|
Total de individuos |
41 |
43 |
|
Riqueza de especies |
17 |
11 |
|
Índice de diversidad de Shannon |
2.67 |
1.9 |
*Especies exóticas o introducidas
En la Figura 9 se observa la estructura de la vegetación en ambas zonas reforestadas, donde los árboles han alcanzado alturas de hasta 10 metros y han formado un dosel cerrado en un periodo relativamente corto de tiempo, lo que ha permitido la eliminación de los pastos agresivos que en otras épocas no permitían el crecimiento de árboles y, por lo tanto, debían ser controlados manualmente.
Además, aunque la mayoría de los árboles está en esta zona por intervención humana (siembra), cabe destacar que algunas especies se establecieron de forma natural, y que las que han logrado sobrevivir y crecer son todas especies características de la zona de vida. Sin embargo, sí se observan diferencias con los sitios de regeneración natural, principalmente en cuanto a la densidad de los árboles y a la presencia de especies que no están en los otros sitios, como Z. longifolia, E. poeppigiana, S. saman, C. niveus, entre otras.

Figura 9: Perfil de la vegetación las dos áreas de reforestación*
Figure 9: Vegetation profile of the two reforestation areas*
*Simbología /Symbology: H. a. = Heliocarpus appendiculatus; Z. l. = Zigia longifolia; A. z. = Samanea saman; P. g. = Psidium guajava; F. c. = Ficus costaricana; A. a. = Acnistus arborecens; R. l. = Robinsonella lindeniana; C. o. = Cecropia obtusifolia; E. p. = Erythrina poeppigiana; L. f. = Lasianthaea fruticosa; S. p. = Senna papilosa; C. d. = Croton draco; F. m. = Ficus maxima; I. d. = Inga densiflora; C. t. = Aiouea montana; T. h. = Trichilia hirta; C. n. = Croton niveus.
A nivel general para toda la reserva, el número de especies de plantas leñosas y herbáceas mayores a 10 cm de diámetro encontradas en las áreas en regeneración en ambos estudios asciende a 49 especies, pertenecientes a 28 familias. Estudios en otros bosques tropicales secundarios han mostrado números similares (Beltrán-Rodríguez et al., 2018; Delgado-Rodríguez et al., 2021; Di Stéfano et al., 1996; Fournier y Herrera, 1985). La familia Fabaceae es la que reportó un mayor número de especies, al igual que en otros estudios sobre restauración de bosques (Delgado-Rodríguez et al., 2021; Granados-Victorino et al., 2017).
En lo que respecta a la composición de especies de cada sitio, se encontró que el mayor cambio se dio en los sitios que en el 2005 eran pastizal, charral, bosque secundario ralo y bureal. Incluso algunas especies pertenecientes a etapas sucesionales tardías, como las de los géneros Cedrela, Cupannia e Inga (Di Stéfano et al., 1996), están presentes en los tres últimos sitios. Por otro lado, el cultivo abandonado y el bosque secundario denso registran el menor cambio. Estos dos sitios se caracterizan por tener una estructura de dosel cerrado desde 2005, lo que ejerce una presión competitiva y lleva a una disminución en las tasas de colonización de nuevas especies (Norden et al., 2015), limitando la supervivencia de sus plántulas.
Por otro lado, el número de árboles y los índices de riqueza y diversidad de especies aumentaron en el pastizal, el charral y el bureal, mientras que en los dos bosques secundarios y el cultivo abandonado se mantuvieron igual o disminuyeron ligeramente. Esto se debe a que en las primeras etapas de la sucesión la colonización de nuevas especies ocurre más rápidamente, mientras que en las etapas un poco más avanzadas el reclutamiento disminuye debido a la presión competitiva mencionada anteriormente y que provoca un fenómeno de exclusión. El sotobosque, al ser más denso, compite por espacio de crecimiento y recursos con las especies arbóreas ya establecidas, lo que provoca que algunos individuos no logren sobrevivir (Beltrán-Rodríguez et al., 2018).
Los mayores cambios en la estructura vertical de la vegetación también se dieron en el pastizal, el charral y el bureal. En el caso del pastizal, la zona específica en la que se realizó el perfil de vegetación contaba con árbol de higuerón (F. aurea), que actuó como núcleo de regeneración. Esto fue de suma importancia en el cambio debido a que la sombra bajo la copa de los árboles aislados en pastizales cambia favorablemente las condiciones microclimáticas y edáficas, de modo que permite el establecimiento de plantas del bosque (Esquivel y Calle, 2002) al abatir la competencia con especies heliófitas (Guevara et al., 2005) y hierbas agresivas, como ciertos pastos. Además, proporcionan importantes hábitats y recursos alimenticios para animales; en especial sitios de anidación, alimentación y descanso de aves que, al visitarlos, regurgitan y defecan semillas, aumentado así la dispersión desde los bosques hacia las áreas abiertas. Además, muchos árboles mantienen abundancia de epífitas en sus troncos y ramas (Harvey et al., 1999), contribuyendo así a enriquecer la biodiversidad.
En el caso del antiguo charral y el bureal, las especies pioneras que ya se habían establecido (C. obtusifolia y H. appendiculatus) también cumplieron un papel fundamental en la rápida recuperación del bosque. Los charrales corresponden a la primera etapa en la que las hierbas, arbustos y trepadoras predominan, ya que se establecen rápidamente después de una alteración o abandono del terreno y se vuelven más escasos bajo la sombra de los árboles pioneros (Fournier, 1989), como los mencionados. Normalmente estas primeras etapas se consideran poco deseables y sin valor económico o ecológico. Sin embargo, se debe reconocer su valor por su papel como vegetación de barbecho (Muller, 2002), que a la larga mejora las condiciones del suelo para las etapas siguientes, tal y como quedó demostrado con esta investigación.
En el 2005, la zona estaba dominada por burío (H. appendiculatus), lo que resultó en una masa forestal uniforme en cuanto a su composición florística y edad. Este tipo de poblaciones es altamente susceptible a plagas, enfermedades, incendios y cambios climáticos abruptos (Fournier, 1989). A pesar de esto, la sombra generada por los buríos mejoró las condiciones del suelo y eliminó la competencia de gramíneas, lo que permitió el establecimiento de otras especies de árboles. Tras 15 años, estas especies reemplazaron a los buríos, los cuales tienen una vida corta propia de las heliófitas efímeras (Gutiérrez, 2003), y dieron lugar a un nuevo bosque secundario con una mayor riqueza de especies.
En el 2005, en la RNMV las extensas áreas de pastizal desprovistas de árboles representaban un gran desafío para la restauración debido a diversos factores propios de estos ambientes, como la limitada dispersión de semillas de especies leñosas por animales, debido a que estos no suelen aventurarse fuera de su hábitat boscoso seguro (Guevara et al., 2005; Morales, 1995). Además, las semillas que logran llegar al pastizal se enfrentan a condiciones adversas para su germinación y establecimiento, como suelos compactados, fluctuaciones extremas de humedad y temperatura del aire y del suelo, así como altos niveles de iluminación solar (Guevara et al., 2005). También, la ausencia de hongos mutualistas (micorrizas) en el suelo impide el crecimiento, adaptación y desarrollo de especies leñosas (Morales, 1995).
En los pastizales existen factores bióticos que resultan desfavorables para el establecimiento de especies arbóreas, como la competencia por nutrientes y luz solar con pastos y malezas de rápido crecimiento (Guevara et al., 2005). Además, el tipo de pastos presentes en el área a restaurar y las especies arbóreas a establecer son factores determinantes en el proceso. En algunos casos, los pastos altamente competitivos crean una acumulación de biomasa en el suelo que dificulta o inhibe el crecimiento de los árboles, lo que se conoce como “colchón” (Morales, 1995). La intensa depredación de semillas y herbivoría de plántulas por organismos de los pastizales que no se encuentran en el bosque también es un factor desfavorable (Guevara et al., 2005). Por estas razones, a menudo se recurre a la reforestación o restauración activa, como fue el caso en la RNMV.
A pesar de las dificultades mencionadas, este estudio demuestra que los esfuerzos realizados por los miembros de la FMV fueron exitosos para establecer un nuevo bosque secundario donde antes solo había pastizales. Sin embargo, esto se logró tras mucho trabajo de control de malezas, abonado y riego de los árboles sembrados, y no todos lograron establecerse (López et al., 2010). Esta investigación aporta información valiosa sobre cuáles especies fueron aptas y podrían utilizarse en otros lugares con condiciones ambientales similares. Además, es importante tener en cuenta que no existe un método único para la restauración de ecosistemas, especialmente en sitios altamente fragmentados y degradados, ya que la recuperación vegetativa depende de la particularidad de cada sitio (Vargas, 2011).
Por ejemplo, la complejidad de los factores del sitio y su interacción con el uso de la tierra es ampliamente reconocida y desafía nuestra capacidad de predecir la sucesión. La variación en la calidad del suelo y el drenaje, la distancia a otros parches de bosque, los cambios continuos en el paisaje circundante, las especies iniciales y la composición funcional, la frecuencia de los incendios y los efectos del vecindario, especies invasoras, control de malezas, último cultivo sembrado, nutrientes, tratamientos, cargas de patógenos y herbívoros, y efecto de borde persistente influyen en las tasas de cambio de la vegetación y la trayectoria sucesional de la comunidad (Norden et al., 2015). Por tanto, es esencial adaptar las estrategias de restauración a las condiciones específicas de cada sitio y tener en cuenta múltiples factores para lograr el éxito en la recuperación de ecosistemas degradados.
En el caso particular de esta reserva, en las zonas sometidas a reforestación se encontraron 22 especies que pertenecen a 13 familias; algunas de estas fueron sembradas y otras se establecieron por sus propios medios. En este sentido, resaltan especies como Z. longifolia, S. saman, P. septenatum y C. niveus, que no se encontraron en ninguno de los sitios de regeneración natural, ni en los remanentes boscosos (Rodríguez y Brenes, 2009), pero que son muy utilizadas para reforestación y fáciles de conseguir. Se destaca la alta densidad de la especie Z. longifolia en ambos sitios, un árbol nativo de Costa Rica que es de gran importancia ecológica debido a su sistema radicular denso, que previene la erosión del suelo (Alvarado et al., 2011). Además, su dosel genera una densa sombra que elimina la competencia de malas hierbas y mejora el microclima, lo que favorece la regeneración natural de especies tolerantes a la sombra y nativas (Delgado-Rodríguez et al., 2021). Este fenómeno ha sido documentado en otros estudios, como en Guariguata y Ostertag (2002), Lamb et al. (2005) y Delgado-Rodríguez et al. (2021).
Cabe destacar que estos esfuerzos de reforestación activa fueron exitosos para la rehabilitación ecológica al restablecer atributos como la estructura y riqueza y diversidad de especies, aunque la composición de especies difiere de las zonas de regeneración natural y los remanentes de bosque (Rodríguez 2007), a pesar de que la estructura vertical y la riqueza se asemejan. A la misma conclusión llegaron Delgado-Rodríguez et al. (2021) en otra zona de Costa Rica, y era de esperarse, ya que la recuperación de la composición de especies es más lenta que la recuperación de la riqueza, estructura y diversidad arbórea. Resultados similares han sido registrados en otros bosques neotropicales, sugiriendo que los ensambles ecológicos sucesionales tardarán en parecerse a los de un bosque primario, aunque es posible la recuperación de su riqueza, estructura y diversidad arbórea en plazos menores a 80 años. Incluso varios estudios en otros bosques tropicales secundarios demuestran que durante la sucesión las etapas intermedias parecen superar en riqueza a los bosques maduros, aun cuando su composición difiere (Beltrán-Rodríguez et al., 2018).
Finalmente, investigaciones como esta permiten llevar un adecuado monitoreo de la restauración para lograr un seguimiento continuo de las acciones desarrolladas con el propósito de obtener información para la toma de decisiones, y evaluar la trayectoria del proceso para garantizar su éxito (Bonilla, 2018), por lo que se recomienda a la FMV continuar este tipo de estudios en el futuro.
Este documento puede servir como modelo y guía para aquellos actores locales que deseen contribuir a la recuperación del bosque, el cual ha sido de gran relevancia para Costa Rica en los últimos años. Esto queda demostrado en el último “Mapa de bosques y otras tierras” publicado por el Sistema Nacional de Áreas de Conservación en noviembre de 2022, que muestra que la cobertura de los bosques secundarios ha alcanzado el 23.25 %, y que, junto con los bosques maduros, representan el 57.1 % del país bajo cobertura forestal (Ortiz, 2022). Además, la relevancia de los bosques secundarios queda demostrada en el hecho de que el país cuenta con legislación específica para el manejo y aprovechamiento sostenible de este ecosistema (SINAC-CONAC, 2021).
Asimismo, puede ser de utilidad en otros países de América Latina con condiciones ambientales similares donde no siempre se cuenta con suficiente investigación científica de este tipo.
En los quince años comprendidos entre el 2005 y el 2020, la RNMV pasó de tener casi la mitad de su extensión cubierta por pastos y charrales (tacotales) a estar cubierta en su totalidad por bosque secundario y dos remanentes que ya existían cuando se creó la reserva.
El mayor cambio se observó en la zona que fue sometida a reforestación (restauración activa), que pasó de estar dominada totalmente por pastos a ser un bosque secundario en apenas 15 años. Sin embargo, hay que tomar en cuenta que esta zona fue sometida a un intenso trabajo de control de pastos que requirió de una gran cantidad de recursos y esfuerzo. Por otra parte, los menores cambios se observaron en los sitios donde ya existía un bosque secundario relativamente maduro, esto debido a que la misma sombra que crean los árboles limita el crecimiento de nuevas especies.
Es crucial destacar que en todos los sitios restaurados predominan especies pioneras nativas, lo que evidencia la efectividad de las estrategias de restauración y asegura el proceso natural de regeneración del bosque premontano. Estos hallazgos son de gran importancia para la selección de especies en futuros proyectos de reforestación en áreas similares, asegurando así la supervivencia de los árboles plantados y acelerando el proceso de restauración.
Finalmente, se recomienda dar seguimiento en el futuro a estos mismos lugares para seguir documentado los procesos de sucesión y recambio de especies conforme el bosque vaya madurando y las especies pioneras sean reemplazadas por las de larga vida.
Esta investigación se llevó a cabo gracias al proyecto “Cambios en la estructura y composición de la vegetación como resultado de los procesos de restauración ecológica en la Reserva Madre Verde en los últimos 15 años”, financiado por la Vicerrectoría de Investigación de la Universidad de Costa Rica mediante los Fondos de Estímulo a la Investigación, y desarrollado desde la Sede de Occidente. También se agradece a la FMV y en especial a Pamela Campos y Gerardo Araya por su colaboración y la información suministrada, y a Alex Gonzáles y Ana Méndez por su ayuda como asistentes de campo. Finalmente, se agradece a la revista y las personas revisoras anónimas por sus múltiples observaciones que ayudaron a organizar y presentar mejor la versión final del escrito.
7. Ética y conflicto de intereses
La persona autora declara que ha cumplido totalmente con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la producción del manuscrito; que no hay conflictos de intereses de ningún tipo; que todas las fuentes financieras se mencionan completa y claramente en la sección de agradecimientos, y que están totalmente de acuerdo con la versión final editada del artículo.
Alvarado García, V., Bermúdez Rojas, T., Romero Vargas, M., & Piedra Castro, L. (2011). Selección de plantas para el control de la erosión hídrica en Costa Rica mediante la metodología de criterio de expertos. Recursos Naturales y Ambiente, 63, 41-46. https://repositorio.catie.ac.cr/bitstream/handle/11554/6801/6.%20Alvarado%20et%20al.pdf?sequence=1&isAllowed=y
Amador, S. (2003). Principales problemas ecológicos derivados del crecimiento demográfico y la urbanización. Serie Problemas ecológicos, No 4. Editorial de la Universidad de Costa Rica.
Avella-M., A., García-G., N., Fajardo-Gutiérrez, F. & González-Melo, A. (2019). Patrones de sucesión secundaria en un bosque seco tropical interandino de Colombia implicaciones para la restauración ecológica. Caldasia, 41(1), 12-27. https://doi.org/10.15446/caldasia.v41n1.77929
Beltrán-Rodríguez, L., Valdez-Hernández, J. I., Luna-Cavazos, M., Romero-Manzanares, A., Pineda-Herrera, E., Maldonado-Almanza, B., Borja-de la Rosa, M., & Blancas-Vázquez, J. (2018). Estructura y diversidad arbórea de bosques tropicales caducifolios secundarios en la Reserva de la Biosfera Sierra de Huautla, Morelos. Revista mexicana de biodiversidad, 89(1), 108-122. https://doi.org/10.22201/ib.20078706e.2018.1.2004
Bonilla, V. (2018). Estrategias de restauración de ecosistemas en un sitio degradado del bosque húmedo premontano transición seca. Repertorio Científico, 21(2), 237-58. https://doi.org/10.22458/rc.v21i2.2408
Cascante, A. y Estrada, A. (2001). Composición florística y estructural de un bosque húmedo premontano en el Valle Central de Costa Rica. Revista de Biología Tropical, 49(1), 213-225.
Delgado-Rodríguez, D., Sierra-Parra, A.M., Villalobos-Soto, R., Herrera-Martínez, C. G., Gutiérrez, M., & Quijano-Prieto, N. (2021). Estrategias de restauración activa en áreas de potrero del corredor biológico Rincón-Cacao, Costa Rica: Estado de la biodiversidad vegetal 20 años después de su implementación. Serie técnica. Informe técnico no. 429. CATIE. https://repositorio.catie.ac.cr/bitstream/handle/11554/11470/BCO22028419e.pdf?sequence=5&isAllowed=y
Díaz-Triana, J., Torres-Rodríguez, S., Muñoz-P, L. y Avella-M, A. (2019). Monitoreo de la restauración ecológica en un bosque seco tropical interandino (Huila, Colombia): programa y resultados preliminares. Caldasia, 41(1), 60-77. https://doi.org/10.15446/caldasia.v41n1.71318
Di Stéfano, J., Nielsen, V., Hoomas, J. y Fournier, L. (1996). Regeneración de la vegetación arbórea en una pequeña reserva forestal urbana del nivel premontano húmedo, Costa Rica. Revista de Biología Tropical, 44(2), 575-580. https://revistas.ucr.ac.cr/index.php/rbt/article/view/21647
Duarte, N., Cuesta, F., Terán, E., Pinto, E., Arcos, I., Solano, A. y Torres, O. (2017). Protocolo para monitoreo de áreas de restauración ecológica en los bosques montanos de la Cordillera Occidental del Ecuador. CONDESAN, Fundación Imaymana.
Esquivel, M. y Calle, Z. (2002). Árboles aislados en potreros catalizadores de la sucesión en la Cordillera Occidental Colombiana. Agroforestería en las Américas, 9, 33-34. http://web.catie.ac.cr/informacion/RAFA/rev33-34/avances7.htm
Fournier, L. y Herrera, M. (1985). Recuperación del bosque premontano húmedo y muy húmedo del cantón de Mora, Costa Rica. Revista de Biología Tropical, 33(2), 151-155.
Fournier, L. (1989). Importancia de la reforestación en Costa Rica. Agronomía Costarricense, 13(1), 127-133. https://www.mag.go.cr/rev_agr/v13n01_127.pdf
Granados-Victorino, R. L., Sánchez-González, A., Martínez-Cabrera, D. y Octavio-Aguilar, P. (2017). Estructura y composición arbórea de tres estadios sucesionales de selva mediana subperennifolia del municipio de Huautla, Hidalgo, México. Revista mexicana de biodiversidad, 88(1), 122-135. https://revista.ib.unam.mx/index.php/bio/article/view/1659/1425
Guevara, S., Laborde, J. y Sánchez-Ríos, G. (2005). Los árboles que la selva dejó atrás. Interciencia, 30(10), 595-601. https://www.redalyc.org/pdf/339/33910903.pdf
Gutiérrez, A. M. (2003). Propagación del burío (Heliocarpus appendiculatus Turcz.) por semillas, estacas y acodos. Turrialba: CATIE.
Guariguata, M. y Ostertag, R. (2002). Sucesión secundaria. En M.R. Guariguata y G. H. Kattan (Eds.), Ecología y conservación de bosques neotropicales. Ediciones LUR.
Harvey, C., Haber, W. A., Solano, R., & Mejías, F. (1999). Árboles remanentes en potreros de Costa Rica: ¿Herramientas para la conservación? Agroforestería en las Américas. 6(24), 19-22. https://www.researchgate.net/profile/Celia-Harvey/publication/328942359_Arboles_remanentes_en_potreros_de_Costa_Rica_Herramientas_para_la_conservacion/links/5bec5c05299bf1124fd1fefe/Arboles-remanentes-en-potreros-de-Costa-Rica-Herramientas-para-la-conservacion.pdf
Lamb, D., Erskine, P. y Parrotta, J. (2005). Restoration of Degraded Tropical Forest Landscapes. Science 310(5754), 1628-1632. https://www.researchgate.net/publication/7431192_Lamb_D_P_D_Erskine_and_J_A_Parrotta_Restoration_of_degraded_tropical_forest_landscapes_Science
López, Y., Arteaga, B. y Sánchez, Y. (2010). Evaluación de las plantaciones realizadas en la Reserva Madre Verde, Palmares de Alajuela, Costa Rica. Estancia pre-profesional en Ingeniería en Restauración Forestal. Universidad Autónoma de Chapingo.
Morales, D. (1995). Restauración de Bosques Tropicales en Pastizales. Revista Informativa Rothschildia, 2(1). https://www.acguanacaste.ac.cr/rothschildia/v2n1/textos/12.html
Muller, E. (2002). Los bosques secundarios salen a la luz. Actualidad Forestal Tropical, 10(4), 16-18.
Norden, N., Angarita, H. A., Bongers, F., Martínez-Ramos, M., Granzow-de la Cerda, I., van Breugel, M., Lebrija-Trejos, E., Meave, J.A., Vandermeer, J., Williamson, G. B., Finegan, B., Mesquita, R. & Chazdon, R. L. (2015). Successional dynamics in Neotropical forests are as uncertain as they are predictable. Proceedings of the National Academy of Sciences of the United States of America, 112(26), 8013-8018. https://www.pnas.org/doi/10.1073/pnas.1500403112
Ortiz, L. (25 de noviembre, 2022). Lanzan mapa de bosques y otras tierras del país. UNA comunica. https://www.unacomunica.una.ac.cr/index.php/noviembre-2022/4328-lanzan-mapa-de-bosques-y-otras-tierras-del-pais
Rodríguez, C. (2007). Evaluación ecológica de la Reserva Madre Verde (Palmares 2005-2006) como base para su manejo sostenible [Tesis de maestría en Desarrollo Sostenible]. San Ramón: Sede de Occidente, Universidad de Costa Rica.
Rodríguez C. y Brenes L. (2009). Estructura y composición de dos remanentes de bosque premontano muy húmero en la Reserva Madre Verde, Palmares, Costa Rica. Pensamiento Actual, 9(12-13), 117-124.
Sánchez, Y., Tapia, M. y Salazar, J. (2017). Importancia cultural de vegetación arbórea en sistemas ganaderos del municipio de San Vicente del Caguán, Colombia. Revista UDCA Actualidad & Divulgación Científica, 20(2), 393-401. https://revistas.udca.edu.co/index.php/ruadc/article/view/397/338
SINAC-CONAC (2021). Manual de procedimientos para el manejo de los bosques secundarios. https://www.sinac.go.cr/ES/noticias/Documents/Manual%20de%20procedimientos%20completo%20para%20publicar.pdf
Smith, T. M. y Smith, R. L. (2007). Ecología. Madrid: Pearson Educación.
Vargas, O. (2011). Los pasos fundamentales en la restauración ecológica. La restauración ecológica en la práctica. Memorias del I Congreso Colombiano de Restauración ecológica y II Simposio Nacional de Experiencias en Restauración Ecológica. Universidad Nacional de Colombia.
Zhongming, Z., Linong, L., Xiaona, Y., Wangqiang, Z. y Wei, L. (2021). Action Plan for the Decade on Ecosystem Restoration in Latin America and the Caribbean. Programa Ambiental de las Naciones Unidas. https://wedocs.unep.org/bitstream/handle/20.500.11822/34950/ActionPlan_Restoration_LAC.pdf?sequence=1&isAllowed=y
1 Docente e investigadora, Sección de Biología, Sede de Occidente, Universidad de Costa Rica; Costa Rica. cindy.rodriguez_a@ucr.ac.cr; https://orcid.org/0000-0002-4074-8094
Escuela de Ciencias Ambientales,
Universidad Nacional, Campus Omar Dengo
Apartado postal: 86-3000. Heredia, Costa Rica
Teléfono: +506 2277-3688
Correo electrónico revista.ambientales@una.ac.cr




