ISSN: 1659-455X • e-ISSN: 1659-407X
Vol. 12 (2), julio-diciembre 2020
REVMAR
REVISTA CIENCIAS MARINAS Y COSTERAS
Recepción 30 julio 2020 • Corregido 26 octubre 2020 • Aceptado 26 octubre 2020
DOI: https://dx.doi.org/10.15359/revmar.12-2.3
Metales trazas (Fe, Mn, Zn, Cu) en el poliqueto Americonuphis reesei (Clase: Polychaeta), en la playa El Salado, Aguadulce, Panamá
Trace metals (Fe, Mn, Zn, Cu) in the polychaete Americonuphis reesei (Class: Polychaeta), in El Salado Beach, Aguadulce, Panamá
Diana Rodríguez1, Janzel R. Villalaz2, Italo Goti3*, Orlando Leone4 & Juan A. Gómez H.2
RESUMEN
Se determinó la concentración de metales trazas Fe, Mn, Zn, Cu en el homogeneizado de todo el tejido del poliqueto Americonuphis reesei, en tres estaciones de muestreo en la playa El Salado, bahía de Parita, en temporada seca de 2017. En cada estación, se establecieron tres puntos de colecta, separados por 50 m entre sí. Las muestras fueron digeridas con ácido nítrico y los metales se determinaron por espectrofotometría de absorción atómica. Los máximos valores registrados fueron el Fe, con promedio de 581.98 µg·gˉ¹, seguido del Mn con 25.71 µg·gˉ¹. Los valores más bajos se reportaron para el Zn, 16.05 µg·gˉ¹ y el Cu, 3.52 µg·gˉ¹. Existe correlación significativa entre los metales Fe y Mn (r= 0.95), Mn y Cu (r= 0.71) P < 0.01 y altamente significativa entre Fe y Cu (r= 0.64) P < 0.002. Las tallas de los poliquetos, medidos con cinta métrica, en las estaciones 1 (río Santa María) y 3 (Palo Blanco) no presentaron diferencias significativas, pero en El Playón hubo diferencias con respecto a las otras. Las tallas y los metales no se relacionaron. Los valores entre los puntos de colecta indican que existe diferencia significativa de Mn y Fe en las zonas 1 y 3, y de Fe entre la 1 y 2. Los metales detectados en los tejidos no suponen riesgo, ya que están por debajo de los valores de los estándares establecidos.
Palabras clave: acumulación, golfo de Panamá, metales, poliquetos, talla
ABSTRACT
The concentration of the heavy metals Fe, Mn, Zn, and Cu was determined in a homogenized sample of the polychaete Americonuphis reesei tissue in three sampling stations in Playa El Salado, Parita Bay, during the dry season in 2017. Three sampling locations were established at each station, 50 m apart from each other. Samples were digested with nitric acid, and metal concentration was determined by atomic absorption spectrophotometry. The highest concentration recorded was Fe, with an average of 581.98 µg·gˉ¹, followed by Mn with 25.71 µg·gˉ¹. The lowest values were reported for Zn, 16.05 µg·gˉ¹ and Cu, 3.52 µg·gˉ¹. A significant correlation was found between Fe and Mn (r = 0.95) and Mn and Cu (r = 0.71) P <0.01 as well as a highly significant correlation between Fe and Cu (r = 0.64) P <0.002. The sizes of polychaetes in stations 1 (Rio Santa María) and 3 (Palo Blanco) show no significant differences; however, sizes in station 2 (El Playón) showed differences compared to the other two stations. No correlation was found between length and metal concentration. Metal concentrations between the stations indicate that there is a significant difference in Mn and Fe in stations 1 and 3, and in Fe between stations 1 and 2. Metals detected in the tissue do not pose any risk since the concentrations are below the values of the established standards.
Keywords: Accumulation, Gulf of Panama, metals, polychaete, size
Los metales, elementos naturales en el ambiente, se constituyen en micronutrientes para los seres vivos, en especial en las plantas (Alleoni et al. 2005; Duarte, 2003). Las deficiencias de estos en los cultivos, se suple con fertilizantes y son manejados con insecticidas para mejorar la producción. El exceso de ellos constituye una fuente antropogénica que incorpora metales en el suelo (Soares, 2004).
Los metales por lixiviación son arrastrados a cuerpos de agua, que finalmente llegan a la zona costera (Pinzón Uribe & Sotelo Rojas, 2016), convirtiéndose en fuente de contaminación que afecta al ambiente y la salud (del Puerto Rodríguez et al. 2014). Una vez en el sedimento marino son incorporados por animales bentónicos, los cuales pueden convertirse en bioindicadores de contaminación (Valdés, Guiñez & Vega, 2014; del Pilar Ruso et al. 2017).
Los poliquetos, componentes importantes de las comunidades bentónicas tiene función ecológica en el reciclado de la materia orgánica, sobre todo en la zona litoral (Díaz, 2003), entre ellos se encuentra Americonuphis reesei, de las 180 especies que han sido reportadas para Panamá (Fauchald, 1973), y habitan en planicies areno-fangosas de la zona intermareal que se caracteriza por distribución espacial en parches (Rojas & Vargas, 2008).
En Panamá se han realizado algunas investigaciones de A. reesei sobre alimentación y comportamiento en acuarios (Luna & López, 2001a), fisiología y bioquímica (Luna & López, 2001b, Gómez et al. 2001b), reproducción (Luna et al. 2001a), morfometría (Luna et al. 2001b) y análisis pesquero (Vega, Robles & Torres, 2014).
Esta especie tiene gran importancia comercial en la industria acuícola, especialmente en el cultivo de camarones, debido a la importancia nutricional, en particular por el efecto sobre la reproducción, ya que es fuente de prostaglandinas utilizadas en maricultura para inducir la maduración gonadal de los camarones peneidos Litopenaeus vannamei y L. stylirostris (D’Croz et al. 1988).
La zona costera aledaña al sitio de colecta se caracteriza por poseer un desarrollo agrícola importante, con cultivos como caña, arroz, maíz y otros, en cuyos cultivos se utilizan agroquímicos que contienen Fe, Mn, Cu y Zn en su estructura (MIDA, 2019).
No hay reportes sobre investigaciones de metales trazas en el tejido de A. reesei, debido a ello, es importante conocer los niveles de concentración de estos elementos, ya que, al ser utilizados como alimento para los camarones reproductores de cultivo, puede afectar la actividad reproductiva.
El estudio se realizó en la playa El Salado situada en la ciudad de Aguadulce, localizada a 252 kilómetros, de la ciudad de Panamá, a 8° 12̕ 05. 8̕̕ ̕ N 80° 29̕ 00. 7̕ ̕ W (Fig. 1).
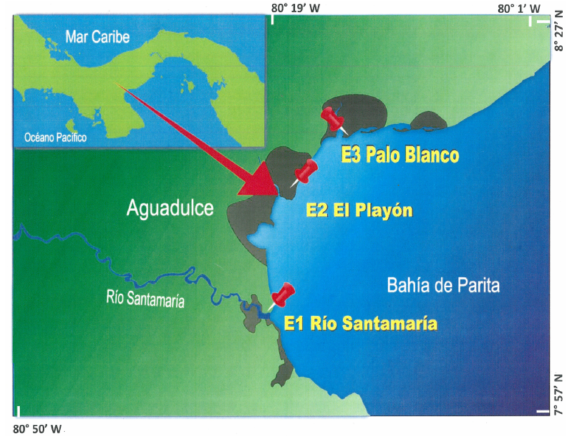
Fig. 1. Localización del área de muestreo y coordenadas de los sitios de colecta. E1 8° 6’ 5” N, 80° 28’ 23” W. E2 8° 13’ 12” N, 80° 27’ 23” W. E2 8° 17’ 23” N, 80° 22’ 18” W.
Fuentes: Google Earth. CNES/Airbus. Data SIO, NOAA, U.S. Navy, NGA, GEBCO. 2020. Escala: 1:40000
Fig. 1. Location of the sampling area and coordinates of the collection sites. E1 8° 6’ 5” N, 80° 28’ 23” W. E2 8° 13’ 12” N, 80° 27’ 23” W. E2 8° 17’ 23” N, 80° 22’ 18” W.Sources: Google Earth. CNES/Airbus. Data SIO, NOAA, U.S. Navy, NGA, GEBCO. 2020. Scale: 1:40000
Se establecieron 3 estaciones de colecta, estación 1 en la desembocadura del río Santa María, la estación 2 en El Playón y estación 3 en el estero Palo Planco. Las colectas se hicieron en periodo de mareas más bajas de sicigia de luna nueva, en la temporada seca de 2017. Los organismos se extrajeron del sedimento con una bomba de aire manual, según lo establecido por Gómez et al. (2001b), el cual consiste en inyectar aire en la entrada del tubo, para expulsar a presión al organismo por la parte posterior.
En cada estación se colectaron tres repeticiones al azar, que constaban de 5 individuos, cada una, separadas 50 m entre sí. Los individuos colectados, alcanzaron longitudes entre 14 y 60 cm, separados en bolsas plásticas, etiquetados, congelados y transportados al Laboratorio de Absorción Atómica de la Universidad de Panamá (Fig. 2).
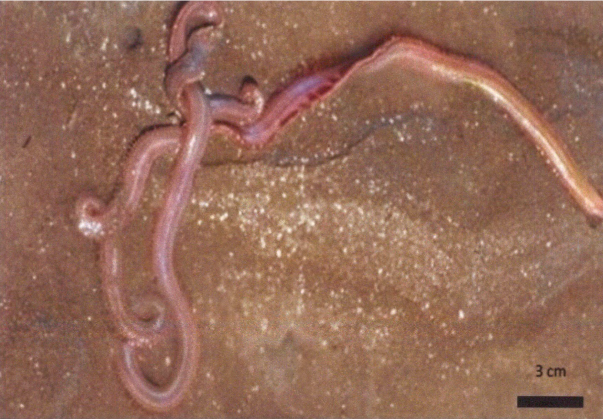
Fig. 2. Poliqueto Americonuphis reesei, playa El Salado, Aguadulce
Fig. 2. Polychaete Americonuphis reesei, El Salado Beach, Aguadulce
Los organismos fueron secados en un horno a 60°C durante 72 horas, hasta peso constante y 1.00 g del material seco fue calcinado en una mufla a 350°C por 1 hora, de acuerdo a la metodología establecida por Carmody, Pearce y Yasso 1973, modificada. La ceniza fue sometida a digestión húmeda en 5 mL de HNO3 50% v/v y filtrada con papel Albet 135 para análisis cuantitativo. El volumen recogido se completó con agua nanopura en matraces volumétricos y aforados hasta 25 ml, de donde se traspasaron a viales cilíndricos de 10 mL e incorporadas al auto muestreador. Para la preparación de los estándares de calibración, se utilizaron patrones concentrados de 1 000 mg/L de la marca Merck (Single- Element Standards Certipur for AAS) y se prepararon soluciones madres intermedias de 100 mg/L y 10.0 mg/L. Se tomaron alícuotas para preparar estándares en el rango óptimo de concentración de cada elemento, para preparar la curva de calibración Cu (0.20 - 10 mg/L), Fe (0.30 - 10 mg/L), Mn (0.10 - 10 mg/L) y Zn (0.05 - 2 mg/L), mediante un espectrofotómetro de Absorción Atómica Shimadzu 6800 con auto muestreador ASC-6100 con capacidad de 30 viales. Se atomizó la muestra con llama aire acetileno y se corrigió la señal no atómica con lámpara correctora de deuterio. Se aplicaron las longitudes de onda para cada metal Cu (324.7 nm), Fe (248.3 nm), Mn (279.5 nm) y Zn (213.9 nm). Se siguió la metodología establecida por Dalziel & Baker (1983). Los valores obtenidos fueron transformados y expresados como µg·g-1 de peso seco (ps) y comparados con material de referencia (Standard Reference Material SRM 1566b Oyster tissue, US Departament of Commerce, Techology, Gathersburg, MD).
Se determinó la normalidad de los datos mediante la prueba de D’Agostino y la homocedasticidad con la prueba de Barttlet, debido a la no estabilización de la varianza se utilizó estadística no paramétrica.
La prueba de Kruskal Wallis se utilizó en la determinación de diferencias de tallas de A. reesei y concentración de metales en el tejido, entre estaciones, y la prueba Post Hoc de Dunn para confirmar las posibles diferencias. Se aplicó la correlación de Spearman en la determinación de posible relación entre diferentes metales. Se realizó el análisis de componentes principales (ACP) para determinar la variabilidad de los metales entre las estaciones.
El análisis de escalamiento multidimensional no métrico se utilizó en la evaluación de similitudes entre estaciones con respecto a la concentración de metales, y la correlación de Spearman para determinar relaciones entre la talla de los poliquetos y la concentración de metales en el tejido.
El análisis estadístico inferencial se realizó con BioEstat 5.3 (Ayres et al. 2007) y la estadística multivariante con PAST (Hammer et al. 2001).
La talla de A. reesei varió entre las estaciones de la siguiente manera: estación 1 el promedio fue de 46.53 cm ± 6.81, estación 2 fue de 23.86 cm ± 6.69, mientras que la estación 3 fue 38.26 cm ± 3.83. No existe diferencia significativa de tallas entre estaciones (K-W. H = 33.58 P > 0.05).
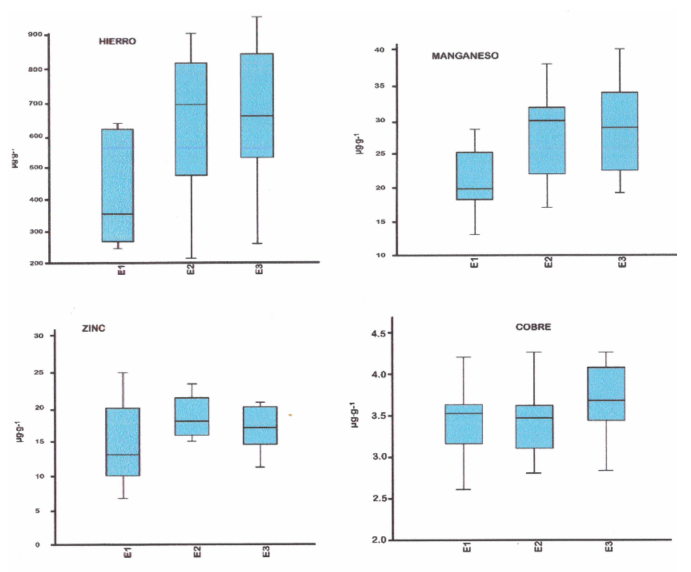
En el caso de los metales, se encontró una concentración promedio en las tres estaciones, en el tejido de A. reesei, Hierro 581.98 µg·gˉ¹ ± 237.30, Manganeso 25.71 µg·gˉ¹ ± 6.75, Zinc 16.05 µg·gˉ¹ ± 4.36 y Cobre 3.52 µg·gˉ¹ ± 0.45 (Fig. 3). La concentración de metales mostró una relación Fe>Mn>Zn>Cu. La correlación de Spearman indicó ser significativa entre el cobre y el hierro (r = 0.64 P < 0.02) y altamente significativa del hierro con el manganeso (r =0.95 P < 0.001), y del cobre con el manganeso (r = 0.71 P < 0.001).
Fig. 3. Concentración de metales (μg·g-1) en el tejido de A. reesei en las estaciones: E1 río Santa María, E2 El Playón y E3 estero Palo Blanco. A. Cobre, B. Hierro, C. Manganeso, y D. Zinc
Fig. 3. Metal concentration (μg · g-1) in the A. reesei tissue at stations E1 Santa María River, E2 El Playón, E3 Estero Palo Blanco. A. Copper, B. Iron, C. Manganese, and D. Zinc
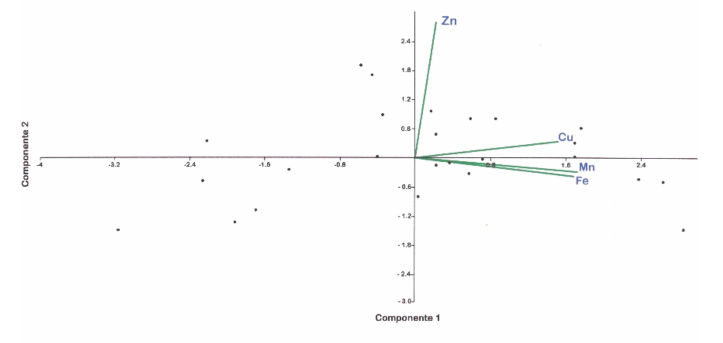
El análisis de componentes principales indicó que el manganeso, cobre y hierro explican el 64 % de la varianza, mientras que el zinc el 25 % de esta. Se observó una relación directamente proporcional de Fe, Cu y Mn, no así con Zn (Fig. 4).
Fig. 4. Análisis de componentes principales de los metales en el tejido de A. reesei de la playa El Salado
Fig. 4. Analysis of main components of metals in the tissue of A. reesei from El Salado Beach
El cobre no mostró diferencias significativas, en el tejido de los poliquetos, entre estaciones (K-W H=1.92 P > 0.05), ni el zinc (K-W H = 0.41 P > 0.05), sin embargo, el hierro presentó diferencias significativas (K-W H=7.47 P < 0.05), la prueba de Dunn mostró que esta diferencia se presentó entre las estaciones 1 (Med. = 356,27 ± 172.56) y 2 (Med. = 702.00 ± 237.34), y entre 1 y 3 (Med. = 669.71 ± 223.11) (P < 0.01). Además, el manganeso presentó diferencias significativas entre estaciones (K-W H = 5.99 P < 0.05), la prueba de Dunn confirmó diferencias entre las estaciones 1(Med. = 11.96 ± 4.54) y 3 (Med = 28.60 ± 6.74).
No obstante, el análisis multidimensional no métrico, indicó que no hay diferencia entre estaciones, si consideramos todos los metales. Sin embargo, las estaciones 2 y 3 son muy semejantes entre sí, en relación con la estación 1 (Fig. 5).
Fig. 5. Análisis multidimensional no métrico de las muestras de metales en tejido de A. reesei, en las estaciones: E1 río Santa María, azul, E2 El Playón, rojo y E3 estero Palo Blanco, verde
Fig. 5. Non-metric multidimensional analysis of metal samples in the tissue of A. reesei, at stations E1 Santa María River, blue, E2 El Playón, red, and E3 Estero Palo Blanco, green
No se observó correlación, de Spearman, entre la talla de los poliquetos y la concentración de los metales estudiados: Fe (r = 0.53), Mn (r = 0.55), Zn (r = 0.20) y Cu (r = 0.16) (P > 0.05).
La zona de estudio ha sido caracterizada por ser un litoral areno-fangoso y playa de arena gruesa, con una marcada separación de las líneas de marea alta y baja, con protección del efecto de olas debido a la presencia de manglares que pueblan sus costas (Gómez et al. 2001a), ambiente en el cual habitan los poliquetos A. reesei (Rojas & Vargas, 2008), especie que vive asociada a otros poliquetos, que puede sobrevivir en medio estresante, por lo que resultan útiles como bioindicadores de contaminación.
Los individuos colectados alcanzan longitudes inferiores a las encontradas por Luna, Villalaz & López (2001b) en la misma zona y Vega et al. (2014) en el golfo de Montijo. Las tallas no superan el metro de longitud, aun cuando Rojas & Vargas (2008) señalan que a estos organismos se les considera uno de los anélidos más grandes del mundo.
En las estaciones 1 y 2, es donde más se extrae el poliqueto, según estudios realizados por ARAP (2014), no así en la estación 3 donde las capturas son menores. Rojas & Vargas (2008) indican que A. reesei forma concentraciones de individuos, a manera de banda continua o discontinua, por lo que podemos deducir que en la estación 1, donde hay mayor agregación de individuos, corresponde a una banda continua densa de bancos longevos muy desarrollados.
En la estación 2, las agregaciones son discontinuas (bancos con menor desarrollo), segunda área más explotada, y tallas de A. reesei, menores que en las otras dos estaciones, por lo que asumimos que los bancos son relativamente jóvenes. Sin embargo, en la estación 3, a pesar de que la agregación es discontinua, los organismos alcanzan tallas mayores, por estar sometidos a menor presión de captura.
La zona costera del área de estudio posee un desarrollo agrícola importante, en la cual se registran 23 750 ha de cultivo de caña de azúcar (MIDA, 2019), 33 103 ha de arroz y 15 500 ha de maíz (INEC, 2019). Según Bravo et al. (2015) y Villarreal et al. (2018), en los cultivos antes mencionados, se utiliza ampliamente fungicidas, y herbicidas que contienen concentraciones elevadas de Cu y Zn, además de Fe y Mn, provenientes estos últimos del suelo de las cuencas hidrográficas próximas al sitio de estudio, debido a las características geoquímicas, y su abundancia en la cuenca alta del curso de los ríos.
De acuerdo con ANAM (2009), los afluentes de las zonas de estudio no están contaminadas con metales traza, sin embargo, Villarreal et al. (2018) reportan niveles elevados de estos, procedentes de los agroquímicos utilizados en la cuenca del río La Villa, que desemboca en la bahía donde se encuentra la zona de estudio.
Las diferentes actividades humanas podrían incidir en el aumento de los metales, a tal punto que afecten el ciclo natural al producir concentraciones elevadas en los organismos (Tulonen et al. 2006). Metales liberados al ambiente llegan a los sistemas acuáticos a través de descarga directa y forman parte de matrices organismo-sedimento. Harikumar et al. (2009) señalan que los metales que llegan al medio acuático se incorporan al sedimento y se acumulan, diversos factores físicos y químicos ambientales los agregan en la interfase sedimento-agua.
Las razones que explican el por qué estos metales fueron analizados obedece a que los mismos según Laws et al. (2016) producen efectos fisiológicos asociados al manejo de agrotóxicos en los trabajadores agrícolas; en ese sentido Chapman et al. (2019) sugieren que la exposición a estas sustancias son un factor de riesgo para la salud, aunque Correa-Rotter et al. (2014) indican que no se ha encontrado una relación directa de agroquímicos y enfermedades en trabajadores de la caña.
Los metales pesados en el medio marino son considerados altamente tóxicos y causan riesgos a la salud pública al ingerir en la dieta organismos que los absorben (Senior Galindo, 2016). Al incorporarse a los tejidos de los poliquetos pueden bioacumularse por el consumo de materia orgánica, cuando las concentraciones ingeridas superan los valores establecidos en el nivel de micronutrientes (Hernández-Almaraz et al. 2018), sin embargo, variaciones ambientales y la influencia antrópica pueden traer como consecuencia diferencias temporales en la disponibilidad de metales en el sedimento y en la incorporación en los organismos marinos (Valdés et al. 2014).
Los organismos bentónicos con hábitos filtradores y depositívoros, se utilizan como buenos bioindicadores de contaminación, tal es el caso del poliqueto Capitela capitata (Ortíz-Gallarza & Ortega-Rubio, 2014); Trevizani et al. (2016) señalan que el comportamiento alimentario de los organismos marinos microfitobentónicos acumulan más Cu que los depositívoros y carnívoros, sin embargo, el Zn es más bioacumulado en estos últimos. En ese sentido, Jakimska et al. (2011) indican que la absorción de metales en los animales marinos, de acuerdo a distintas especies, retienen concentraciones mayores a las del medio. El planteamiento arriba indicado, es importante para explicar los valores encontrados en A. reesei y sugerir si existe o no bioacumulación.
La presencia de metales en la zona costera puede afectar la producción del camarón de cultivo e incidir en las actividades metabólicas, cuando estos sobrepasan los niveles regulables (Lacerda et al. 2006). En ese sentido, Frías-Espericueta et al. (2011) señalan que la incorporación y bioacumulación de metales en la dieta de los camarones de cultivo es importante estudiarla para determinar si sobrepasa los niveles permisibles para consumo humano. Planteamiento que puede servir para asociar los niveles de metales de A. reesei cuando son utilizados en la dieta de los reproductores de camarón.
La concentración de hierro, como elemento más abundante en este estudio, responde a los efectos de erosión producidos en las cuencas que desembocan en la zona costera (Villarreal-Núñez et al. 2018), la cual queda disponible y absorbidos por filtración por los poliquetos.
La concentración media registrada de hierro es mayor, comparada a las concentraciones promedio de Mn, Cu y Zn, debido a que se comporta como macroelemento, y coincide con lo reportado por Charzeddine et al. (2002) en los tejidos y sedimentos de la zona costera venezolana donde vive el poliqueto Americonuphis magna.
Entre las estaciones 1 y 2, hay diferencia en la concentración de manganeso en A. ressei, la que puede estar influenciada por la actividad agrícola, debido al tamaño de la cuenca del río Santa María que es la de mayor extensión y amplia zona de cultivos de arroz y caña de azúcar (ANAM, 2009) y estero Palo Blanco localizada en la zona de influencia de las cuencas del Río Grande y Río Chico con cultivos de arroz y caña de azúcar (INEC, 2011), donde se usa fungicida con manganeso incorporado (Melgar et al. 2008).
Con respecto al Zinc, Fernández-Rodríguez & Londoño Mesa (2015), comentan el hecho de que los poliquetos al recibir constantemente pequeñas cantidades de este metal, entre otros, los torna buenos indicadores biológicos.
La baja concentración de zinc y la ausencia de diferencias significativas en los tejidos del poliqueto entre estaciones podrían indicar que el origen de este metal es de fuentes naturales, por el desgaste de las rocas asociadas principalmente a esfalerita (ZnS) y similares (Alloway, 2008), o aportados por la descomposición de la biomasa.
El cobre, aunque exhibe comportamiento de nutriente, por las concentraciones bajas registradas en este estudio, valores elevados pueden producir alteraciones fisiológicas severas, alta toxicidad y efectos mortales en oligoquetos (Roman et al. 2007).
Giangrande et al. (2016) quienes han investigado los niveles de Fe, Mn, Zn y Cu en organismos de la Familia Sabelidae en el Mar Jónico, Italia, donde reportan valores de hierro en Mageloma lanigera, con 769 µg·gˉ¹, Branchioma baridi con 11,90 µg·gˉ¹, de manganeso y 14,50 µg·gˉ¹, de cobre y Sabella spalanzanii 116 µg·gˉ¹, de zinc.
Gaete et al. (2017) indican que Perinereis galpoensis, en Chile, registra valores de 163 µg·gˉ¹, de hierro, 109 µg·gˉ¹ de zinc y 112.40 µg·gˉ¹ de cobre. Estos valores son superiores a los reportados en el presente estudio. Los metales trazar reportados por los estudios anteriores fueron observados en zonas con influencia de desarrollo minero.
Said et al. (2017) reportan concentraciones bajas de 0.18 µg·gˉ¹, de manganeso y 0.31 µg·gˉ¹, de cobre en Nereis succinea en Egipto, los cuales son inferiores a los reportados para A. reesei. El único reporte de especie similar es el de A. magna, por Andrade et al. (1997), en Venezuela, quienes indican una concentración promedio de 1230.12 µg·gˉ¹ de hierro, 8.75 µg·gˉ¹, de manganeso, 66.30 µg·gˉ¹, de zinc y 5.75 µg·gˉ¹, de cobre.
El análisis de correlación de los metales en el tejido de A. reesei, indica que hay una alta relación del Manganeso-Hierro; y Manganeso-Cobre, sin embargo, la relación de Cobre-Hierro es más baja, esto puede ser atribuido a que los óxidos de estos elementos son de mayor capacidad de adsorción y absorción, en comparación a los demás metales suspendidos que coexisten en el área de estudio, como lo explica Guy & Chakrabarti (1975), donde la secuencia de metales particulado y solubles es: Ni>Cr>Co>Cu>Pb>Fe>Zn>Cd.
Gu et al. (2018) encontró que la media de la concentración de los metales en organismos marinos tiene el siguiente orden: Ni>Fe >Zn >Mn >Cr>Cu>Cd>Pb, Villarreal et al. (2018) señalan una secuencia, en temporada seca de: Fe>Mn>Cr>Zn>Ni>Cu>As>Pb. Las secuencias anteriores son parecidas a la encontrada en esta investigación, Fe>Mn>Zn>Cu.
El análisis de componentes principales expresa la relación entre Fe, Mn y Cu, los cuales explican la variabilidad del componente 1 del ACP y la separación del Zn en el componente 2, donde no queda claro la no relación de este último elemento con el resto. No obstante, Giangrande et al. (2016) y Gaete et al. (2017) reportan concentraciones de Zn en otros poliquetos mayores a las encontradas en este estudio.
La relación de talla y concentración de metales indica que no hay evidencia estadística que muestre una correlación clara, a pesar de observase una tendencia positiva en esta relación.
El orden de concentración de metales presentó la siguiente secuencia Fe>Mn>Zn>Cu, estuvieron por debajo de los valores encontrados en la literatura.
No existe relación de la concentración de metales en el tejido de A. reesei, y el tamaño de los ejemplares colectados.
Los metales en el tejido de poliquetos colectados en las tres zonas de estudio, mostraron un comportamiento muy similar entre sí del Cu y Zn, al no observarse diferencias estadísticas de concentración entre sitios de colecta, a diferencia del Fe y Mn.
Alleoni, L. R. F., Borba, R. P. & Camargo, O. A. (2005). Metais pesados: da cosmogênese aos solos brasileiros. En P. V. Torrado, L. R. F. Alleoni, M. A. L. Silva & E. J. Cardoso (Eds.), Tópicos em Ciências do solo (pp. 1-42). Brasil: Viçosa, Sociedade Brasileira de Ciências do Solo.
Alloway, B. J. (2008) Zinc in soils and crop nutrition. Belgium: International Zinc Association.
ANAM. (2009). Autoridad Nacional del Ambiente. Plan de Manejo Integral de la parte alta, media y baja de la Cuenca del Rio Santa María. Panamá: Sin editorial.
Andrade, J., Martins, C., Charzeddine, L. & Martínez, G. (1997). Metales pesados en el poliqueto tubícola Americonuphis magna (Andrews, 1891) (Annelida: Polychaeta). Saber, 9(1), 12-16.
ARAP. (2014). Autoridad de los Recursos Acuáticos. Memorias 2014. Inspección, vigilancia y control, Dirección Regional de Coclé. https://arap.gob.pa/wp-content/uploads/2017/09/ARAP-Memoria-2014-1.pdf
Ayres, M., Ayres Jr., M., Ayres, D. L. & dos Santos, A. S. (2007). BioEstat 5.0. Aplizações estatísticas nas áreas das ciências biológicas e médicas. Brasil: Instituto de Desenvolvimento Sustentável Mamirauá.
Bravo, V., de la Cruz, E., Herrera, G., Moraga, G. & Ramírez, F. (2015). Uso de plaguicidas en cultivos de caña de azúcar en Guanacaste, impacto ambiental y salud humana. AMBIENTICO, 252, 13-28.
Carmody, D. J., Pearce, J. B. & Yasso, W. E. (1973). Trace metals in sediments of New York Bight. Mar. Poll. Bull. 4(9), 132-135. https://doi.org/10.1016/0025-326X(73)90006-4
Chapman, E., Haby, M. M., Illanes, E., Sánchez-Viamonte, J., Elias, V. & L. Reveiz. (2019). Risk factors for chronic kidney disease of non-traditional causes: a systematic review. Pan. American J. Pub. Heal., 43: e35:1-2. https://doi.org/10.26633/RPSP.2019.35
Charzeddine, L., Andrade, J., Martins, C., Gharseddine, S. & Pérez, M. (2002). Variación estacional de metales pesados en A. magna (Annelidae, Polichaeta) y en sedimentos de la región nororiental de Venezuela. Saber, 14(2), 119-125.
Correa-Rotter, R., Wesseling, C. & Johnson, R. J. (2014). CKD of unknown origin in Central America: The case for a Mesoamerican nephropathy. Am. J. Kidney Dis., 63(3), 506-520. https://doi.org/10.1053/j.ajkd.2013.10.062
Dalziel, J. & Baker, C. (1983). Analytical methods for measuring metals by atomic absorption spectrophotometry. FAO Fis. Tech., 212, 14-20.
D´Croz, L., Wong, L., Justines, G. & Gupta, M. (1988). Prostaglandinas and related compounds from the polychaete Worm Americonuphis reesei. Fauchald (Onuphidae) as possible inducers of gonad maturation in penaeid shrimps. Rev. Biol. Trop., 36(2a), 331-332.
Del Pilar Ruso, Y., de la Ossa Carretero, J. A., Fernández Vicente, L. M., Martínez García, E. & Sánchez Lizaso, J. L. (2017). Uso de bioindicadores de comunidades bentónicas como herramientas para la evaluación del impacto ambiental generado en el medio marino. España, Universidad de Alicante.
Del Puerto Rodríguez, A. M, Suárez Tamayo, S. & Palacio Estrada, E. (2014). Efectos de los plaguicidas sobre el ambiente y la salud. Revista Cubana de Higiene y Epidemiología, 52(3), 372-387.
Díaz, V. (2003). Importancia ecológica de los poliquetos. https://www.jornada.com.mx/2003/10/27/eco-polique.html
Duarte, R. P. S. (2003). Avaliação do cádmio (Cd), chumbo (Pb), níquel (N) e Zinco (Zn) em solos e plantas às margens de uma rodovia de tráfego intenso de veículos. (Tese de doutorado não publicada), Faculdade de Ciências Agronômicas, UNESP, Botucatú.
Fauchald, K. (1973). Polychaetes from Central American sandy beaches. Bull. South. Calif. Acad. Sci., 72, 19-31.
Fernández-Rodríguez, V. & Londoño Mesa, M. H. (2015). Poliquetos (Annelida: Polychaeta) como indicadores biológicos de contaminación marina: casos en Colombia. Gestión y Ambiente, 18, 189-204.
Frías-Espericueta, M. G., Aguilar-Juárez, M., Osuna-López, I. Abad-Rosales, Izaguirre-Fierre, G. & Voltolina, D. (2011). Los metales y la camaronicultura en México. Hidrobiología, 21(3), 217-228.
Gaete, H., Álvarez, M., Logos, G., Soto, E. & Jara-Gutiérrez, C. (2017). Assessment of oxidative stress and bioaccumulation of the metals Cu, Fe, Zn, Pb, Cd in the polychaete Perinereis gualpensis from estuaries of central Chile. Ecotoxicol. Environ. Safety, 145, 653-658. https://doi.org/10.1016/j.ecoenv.2017.07.073
Giangrande, A., Licciano, M., del Pasqua, M., Fanizzi, F. P., Migoni, D. & Stabili, L. (2016). Heavy metals in five Sabellidae species (Annelida, Polychaeta): ecological implications. Environ. Sci. Pollut. Res., 24, 3759-3768. https://doi.org/10.1007/s11356-016-8089-8
Gómez J. A., Herrera, R. V., Ríos, V. & Villalaz, J. R. (2001a). Análisis de sedimentos y organismos de la infauna de playa El Salado de Aguadulce. Tecnociencia, 3(1), 81- 94.
Gómez, J. A., Murillo, E., Villalaz, J. R. & Cogley, A. (2001b). Determinación de lípidos en el poliqueto Americonuphis reesei en las playas El Salado, Aguadulce y Agallito, Chitre. Scientia, 16(2), 37-44.
Gu, Y. G., Ning, J. J., Ke, C. L & Huang, H. H. (2018). Bioaccessibility and human health implications of heavy metals in different trophic level marine organisms: A case study of the South China Sea. Ecotoxicol. Environ. Saf., 163, 551-557. https://doi.org/10.1016/j.ecoenv.2018.07.114.
Guy, R. D. & Chakrabarti, C. I. (1975, September). Distributions of metals ions between soluble and particulate forms. Int. Conf. Heavy metals in the Environ. Toronto, Canada.
Hammer, O., Harper, D. A. T. & Ryan, P. D. (2001). PAST: Paleontological statistics software package for education and data analysis. Paleontol. Eletrônica, 1, 4-9.
Harikumar, P. S., Nasir, U. P & Mujeebu Rahman, M. P. (2009). Distribution of heavy metals in the core sediments of a tropical wetland system. Int. J. Environ. Sci. Tech., 6, 225-232. https://doi.org/10.1007/BF03327626
Hernández-Almaraz, P., Méndez Rodríguez, L, Serviere-Zaragoza, E. & González-Aravena, M. (2018). Consumidores primarios: Bioacumulación y transferencia de metales a invertebrados. En M. Jaime P. Hernández. (Ed.), Bioacumulación y transferencia de metales y contaminantes emergentes a través de las cadenas tróficas marinas (pp. 62-161). México: SAMSARA Editorial.
INEC. (2011). Superficie sembrada y cosechada de arroz en la República, por método de siembra utilizado, según provincia, comarca indígena y período de siembra: año agrícola 2011-2012. https://www.inec.gob.pa/archivos/P5291312-08.pdf
INEC. (2019). Superficie sembrada y cosechada de arroz, maíz y frijol de bejuco: Año agrícola 2018 – 2019. https://www.inec.gob.pa/archivos/P0533424202002070853237.pdf
Jakimska, A., Konieczka., P. K. Skóra , K. & Namieśnik, J. (2011). Bioaccumulation of metals in tissues of marine animals, Part I: the role and impact of heavy metals on organisms. Pol. J. Environ. Stud., 20(5), 1117-1125.
Lacerda, L. D., Santos, J. A. & Madrid, R. M. (2006). Copper emission factors from intensive shrimp aquaculture. Mar. Poll. Bull., 52(12), 1823-1826. https://doi.org/10.1016/j.marpolbul.2006.09.012
Laws, R. L., Brooks, D. R., Amador, J. J., Weiner, D. E., Kaufman, J. S., Ramírez-Rubio, O. & McClean, M. D. (2016). Biomarkers of kidney injury among Nicaraguan sugarcane workers. Am. J. Kidney Dis. 67(2), 209-217. https://doi.org/10.1053/j.ajkd.2015.08.022
Luna, I. G. & López, I. E. (2001a). Aspectos de la alimentación, regeneración y comportamiento de la construcción de los tubos del poliqueto Americonuphis reesei. Scientia, 16, 7-13.
Luna, I. G. & López I. E. (2001b). Comportamiento del consumo de oxígeno en Americonuphis reesei durante el período de estudio (Onuphidae: Polychaeta). Scientia, 16, 15-19.
Luna, I. G., Villalaz, J. & López, I. E. (2001a). Desarrollo gonadal del poliqueto Americonuphis reesei en las playas El Agallito de Chitré y El Salado de Aguadulce (Onuphidae: Polychaeta). Scientia, 16, 21-28.
Luna, I. G., Villalaz, J. & López, I. E. (2001b). Distribución de la biomasa y los parámetros morfométricos en las poblaciones del poliqueto Americonuphis reesei en las playas de El Salado de Aguadulce y El Agallito de Chitré. Scientia, 16, 53-64.
Melgar C., Geissen, V., Cram, S., Sokolov, M., Bastidas, P. & Jarqui, A. (2008). Pollutants in drainage channels following long-term application of Mancozeb tobanana plantations in southeastern Mexico. J. Plant Nutri Soil, 171, 597-604. https://doi.org/10.1002/jpln.200700171.
MIDA. (2019). Resumen según grupos de cultivos con diferentes tecnologías de producción. Año agrícola 2018-2019. https://www.mida.gob.pa/upload/documentos/cierre___2018-2019_ok.pdf
Ortíz-Gallarza, S. M. & Ortega-Rubio, A. (2014). Los organismos bentónicos como indicadores de la salud ecológica de los océanos. En C. A. González Zuarth, A. Vallarino, J. C. Pérez Jiménez & A. M. Lwo Pfeng. (Eds.), Bioindicadores: Guardianes de nuestro futuro ambiental (pp. 171-192). México; ECOSUR.
Pinzón Uribe, L. F. & Sotelo Rojas, H. (2016, diciembre). Comportamiento de metales pesados entre los lodos bentónicos y la corriente de agua del río Bogotá. 13 congreso Nacional de Medio Ambiente, Madrid.
Rojas, R. & Vargas, J. (2008). Abundancia, biomasa y relaciones sedimentarias de Americonuphis reesei (Polychaeta, Onuphidae) en el Golfo de Nicoya, Costa Rica. Rev. Biol. Trop., 56(Suppl 4), 59-82.
Roman, Y. E., De Schamphelaere, K., Nguyen, L. & Hanssen, C. (2007). Chronic toxicity of copper to five benthic invertebrates in laboratory-formulated sediment: sensitivity comparison and preliminary risk assessment. Sci. Total Environ., 387(1-3), 128-140. https://doi.org/10.1016/j.scitotenv.2007.06.023
Said, R. E. M. AbdAlllah, A. T., Mostfa, M. A. & El-Shimy, N. A. (2017). Biomarker response in the polychaete Nereis succinea as early signal for heavy metals pollution in the Read Sea. Egypt. J. Ecol. Toxicol., 1(104), 2.
Senior Galindo, W. J. (2016). Contenido de metales pesados en organismos acuícolas expendidos en los mercados de la ciudad de Machala, Provincia de El Oro. Ecuador. PROMETEO. Secretaría de Educación Pública, Ciencia y Tecnología e Innovación. http://doi.org/10.5281/zenodo.160419
Soares, M. R. (2004). Coeficiente de distribuição (Kd) de metais pesados em solos do Estado de São Paulo. (Tese de Doutorado não publicada), Escola Superior de Agricultura Luiz de Queiroz, Piracicaba.
Trevizani, T. H., Figueira, R. C. L., Ribeiro, A. P., Theohilo, C. Y. S., Majer, A. P. Petti, M. A. V., & Montone, R. C. (2016). Bioaccumulation of heavy metals in marine organisms and sediments from Admiralty Bay, King George Island, Antartica. Mar. Poll. Bull., 106(1-2), 366-371. https://doi.org/10.1016/j.marpolbul.2016.02.056
Tulonen, T., Pihlstrom, M., Arvola, L. & Rask, M. (2006). Concentrations of heavy metals in food web components of small, boreal lakes. Boreal. Env. Res., 11, 185-194.
Valdés, J., Guiñez, M., Castillo, A. & Vega, S.E. (2014). Cu, Pb, and Zn content in sediments and benthic organisms from San Jorge Bay (northern Chile): Accumulation and biotransference in subtidal coastal systems. Cienc. Mar., 40(1), 45-58. https://doi.org/10.7773/cm.v40i1.2318.
Vega, A. J., Robles P., Y. A. & Torres, L. (2014). Análisis biológico y pesquero de la extracción del poliqueto Americonuphis reesei en el Golfo de Montijo, pacífico panameño. Tecnociencia, 16, 77-93.
Villarreal-Núñez, J. E., Santo-Pineda, A., Villaláz-Pérez, J. A., Ballesteros, N. & Ramos-Zachirsson, I. A. (2018). Metales pesados en suelos y sedimentos en la Cuenca del río La Villa-Panamá. Cienc. Agrop., 29, 41-45.
1 Escuela de Biología, Universidad de Panamá.
dianaerodriguez28@hotmail.com ORCID: https:/orcid.org/0000-0003-0939-1944
2 Departamento de Biología Marina y Limnología, Universidad de Panamá, Panamá.
janzelvillalaz@yahoo.com, ORCID: https:/orcid.org/0000-0001-8914-3216
juanay05@hotmail.com ORCID: https:/orcid.org/0000-0002-9320-1674
3 Centro Regional de Azuero, Universidad de Panamá.
italo.goti@up.ac.pa* ORCID: https:/orcid.org/0000-0001-5702-5389
4 Departamento de Química Analítica, Universidad de Panamá, Panamá.
orlandoleone@gmail.com ORCID: https:/orcid.org/0000-0002-5106-1167