ISSN: 1659-455X • e-ISSN: 1659-407X
Vol. 16 (2), julio-diciembre 2024
Recepción 19 marzo 2024 • Corregido 23 julio 2024 • Aceptado 24 julio 2024
DOI: https://dx.doi.org/10.15359/revmar.16-2.2
 |
Influencia de xenobióticos sobre la luminiscencia de cepas de Vibrio harveyi aisladas de aguas marinas cubanas Influence of xenobiotics on the luminescence of Vibrio harveyi strains isolated from Cuban marine waters Gladys Margarita Lugioyo Gallardo1*, María Victoria Iglesias Rodríguez1, Ayamey Pérez Oduardo1, Eudalys Ortiz Guilarte1, Roberto Núñez Moreira1, Thais Renee Chong Almaguer1 y Carlos Álvarez Valcárcel2* |
RESUMEN
Los ensayos de toxicidad que emplean bacterias luminiscentes constituyen herramientas prometedoras para evaluar la calidad de los ambientes acuáticos, dada la alta sensibilidad de aquellas frente a contaminantes. En esta investigación, se evaluó el efecto de xenobióticos de diferente naturaleza: sales de mercurio, cobre, cromo, plata, hierro y cuatro pesticidas, sobre la luminiscencia de las cepas de Vibrio harveyi CBM-784, CBM-976 y CBM-992, aisladas de aguas de la plataforma de Cuba. Las cepas seleccionadas mostraron una reducción de la emisión luminiscente a los 15 min de exposición a los compuestos evaluados con una secuencia decreciente de toxicidad, consistente, para las tres cepas, como sigue: HgCl2 > CuSO4 ≈ Cuproflow > K2Cr2O7 > Sphere Max ≈ Kospi-sc 130 > AgNO3 > Fe2(SO4)3 > Envidor. Los resultados sugieren que estos cultivos podrían emplearse para el diseño de un biosensor de contaminación, ya que la luminiscencia responde a concentraciones nanomolares de los tóxicos evaluados.
Palabras clave: bacterias, ensayo biológico, contaminación, luminiscencia, xenobióticos
ABSTRACT
Toxicity tests using luminescent bacteria are promising tools to assess the quality of aquatic environments given the high sensitivity of these bacteria to pollutants. The research evaluated the effect of different types of xenobiotics—salts of mercury, copper, chromium, silver, iron, and four pesticides—on the luminescence of Vibrio harveyi strains CBM-784, CBM-976, and CBM-992, isolated from waters of the Cuban platform. The selected strains showed a reduction in luminescent emission at 15 min of exposure to the tested compounds, with a consistent, decreasing sequence of toxicity for all three strains as follows: HgCl2 > CuSO4 ≈ Cuproflow > K2Cr2O7 > Sphere Max ≈ Kospi-sc 130 > AgNO3 > Fe2(SO4)3 > Envidor. Results suggest that these cultures could be used to design a contamination biosensor since luminescence responds to nanomolar concentrations of the tested toxicants.
Keywords: bacteria, biological assay, contamination, luminescence, xenobiotics
La determinación de la toxicidad en ambientes acuáticos se realiza, generalmente, por medio de una combinación de técnicas que incluyen bioensayos, análisis químicos, y estudios ecotoxicológicos. Entre los sistemas biológicos empleados con estos fines, se encuentran cultivos celulares de diversos tipos, protozoos y bacterias luminiscentes (Kurbatska & Orobchenko, 2022). Estas metodologías brindan información valiosa sobre la toxicidad para los organismos vivos de compuestos individuales y de sus combinaciones en el medio natural, a diferencia de los más sofisticados y caros análisis físico-químicos, limitados a determinar, individualmente, la naturaleza química y concentración de compuestos (Halmi et al. 2019; Muneeswaran et al. 2021).
Las bacterias luminiscentes son un grupo singular de bacterias que poseen la capacidad de emitir luz visible como resultado de su metabolismo (Hong et al. 2017). Cuando se exponen a sustancias peligrosas externas, experimentan alteraciones en sus rutas metabólicas, lo que ocasiona una disminución perceptible de la intensidad de la emisión luminiscente (Wang et al. 2021). Basándose en este fenómeno, las bacterias luminiscentes se han utilizado de manera efectiva para medir la toxicidad ambiental, al evaluar las alteraciones en la luminiscencia, con estudios que datan de principios de la década de 1980 (van der Meer & Belkin, 2010). Desde entonces, los ensayos de biotoxicidad basados en bacterias luminiscentes han demostrado su sencillez, rapidez, sensibilidad, adaptabilidad y reproducibilidad, de manera que se han utilizado ampliamente para la detección de diversos contaminantes ambientales en las últimas décadas (Yang et al. 2023).
La emisión de luz por las bacterias luminiscentes es el resultado del sistema enzimático luciferina-luciferasa que se encuentra íntimamente relacionado con los procesos de transferencia de energía en las células (Martín et al. 2010). Asimismo, este fenómeno solo ocurre cuando existe alta densidad celular, regulado por un sistema denominado “percepción del quórum” (quorum sensing) (Martín et al. 2010), aunque, al menos en el caso de Photobacterium phosphoreum ANT-2200, se ha demostrado que la emisión de la luz no es dependiente de la densidad del cultivo (Tanet et al. 2019).
El uso de estas bacterias como organismos indicadores de toxicidad se fundamenta en el hecho de que algunos sistemas bioquímicos y fisiológicos se encuentran altamente conservados durante la evolución y determinados xenobióticos actúan de manera análoga en diversos organismos (Boynton, 2009; López-Roldan et al. 2012; Girotti et al. 2015; Yang et al. 2022). Las diferencias que existen entre especies, en los modos de acción de los agentes tóxicos, dependen de la especialización de los sistemas bioquímicos y fisiológicos. Los ensayos con bacterias luminiscentes, en general, muestran buena correlación con respecto a los bioensayos de toxicidad usando otros organismos más complejos como algas, crustáceos y peces (Sáenz & Nevárez, 2010; Girotti et al. 2015; Vega-Corrales & Marín-Vindas, 2021).
Debido a la sensibilidad, la reproducibilidad, la rapidez y al bajo costo de los bioensayos que emplean bacterias luminiscentes, se han recomendado como parte de un conjunto de análisis para el establecimiento de la toxicidad en algunos ecosistemas (Parvez et al. 2006; Camanzi et al. 2011; Bolelli et al. 2016; Ramteke et al. 2019; Kurbatska & Orobchenko, 2022; Park et al. 2023).
El empleo de bacterias luminiscentes marinas como biosensores ambientales es una práctica común desde hace más de 20 años y se han desarrollado ensayos como el de MICROTOX, MUTATOX, LUMISTox (Beckman Instruments) y Tox-Alert de Merck, entre otros, que detectan compuestos tóxicos en las aguas y sedimentos (Beh et al. 2010; Fernández-Pinas et al. 2014). Teniendo en cuenta las ventajas que ofrece el ensayo de toxicidad con bacterias luminiscentes para el fortalecimiento de los programas de vigilancia de la calidad ambiental, el objetivo de este trabajo fue evaluar el efecto de algunos metales y plaguicidas sobre la emisión de luz de las cepas V. harveyi CBM-784, CBM-976 y CBM-992, aisladas de las aguas de la plataforma marina de Cuba.
Las bacterias marinas luminiscentes Vibrio harveyi CBM-784, CBM-976 y CBM-992, aisladas de aguas marinas de la plataforma insular de Cuba, están depositadas y registradas en la Colección de Bacterias Marinas del Instituto de Ciencias del Mar (ICIMAR). El medio empleado para el mantenimiento de estos cultivos fue el LM, recomendado para el aislamiento de bacterias luminiscentes (Baumann & Baumann, 1981). El método de conservación utilizado fue el de subcultivos bajo aceite mineral estéril y almacenamiento en refrigeración (5-10oC) (Kirsop & Doyle, 1991).
Para la evaluación del efecto de xenobióticos sobre la luminiscencia de las tres cepas de V. harveyi se seleccionaron nueve compuestos a diferentes concentraciones, que incluyeron las sales de metales: HgCl2 (0.01-3.70 mg/L), K2Cr2O7 (0.70-90.0 mg/L), AgNO3 (1.3-320.0 mg/L), CuSO4 (0.70-90.0 mg/L) y Fe2(SO4)3 (1.3-320.0 mg/L); así como compuestos empleados en la industria agrícola, por ejemplo: Cuproflow (oxicloruro de cobre, fungicida) (0.70-90.0 mg/L), Envidor (espirodiclorofeno, acaricida) (1.3-320.0 mg/L), Kospi-sc 130 (imidacloprid y bifentrina, insecticida sistémico) (1.3-320.0 mg/L) y Sphere Max (trifloxistrobin y cyproconazol, fungicida) (1.3-320.0 mg/L). Con miras a la preparación de las soluciones de trabajo, se utilizó, como disolvente, solución salina 0.9%.
Para la ejecución de los bioensayos de toxicidad, se tomaron alícuotas de los cultivos de las tres cepas de V. harveyi y se incubaron con diferentes concentraciones de los xenobióticos en una relación 1:1 (v:v), en celdas de cuarzo de 3 mL, durante 15 min, en la oscuridad, a una temperatura de 27 ± 2oC . La adición del xenobiótico se realizó toda vez que se comprobara que el cultivo había alcanzado su máxima luminiscencia (Parvez et al. 2006; Beh et al. 2010). En paralelo, se hicieron controles de luminiscencia, a partir de los cultivos con solución salina, para sustituir los xenobióticos durante el mismo tiempo experimental. Las mediciones de luminiscencia se efectuaron en un espectrofluorímetro Shimadzu RF-5301PC (Japón) en modo emisión; con tal fin, se bloqueó la salida del haz de excitación, de manera que se registrara exclusivamente la luminiscencia emitida por las bacterias. Después de adicionadas las soluciones de los compuestos por evaluar, se registraron al menos tres espectros para cada muestra analizada entre 400 y 600 nm. El slit de emisión del espectrofluorímetro se ajustó a 20 nm de la luz emitida. Los espectros se colectaron cada 1 nm y, a partir de ellos, se seleccionó el valor de intensidad de la luminiscencia a la mayor longitud de onda de emisión luminiscente (485 ± 3 nm). En casos en los que fue necesario diluir el cultivo bacteriano, los valores de la luminiscencia se corrigieron por el factor de dilución. Los datos de luminiscencia se procesaron con el programa OriginPro (2024).
El efecto de la concentración de los compuestos tóxicos se evaluó siguiendo un diseño en bloques completamente aleatorizados, en el que los bloques correspondían a los xenobióticos seleccionados.
Cálculo de la EC50
Para el cálculo de la concentración de cada xenobiótico que produjo un decrecimiento de un 50% de la luminiscencia, se siguió lo propuesto por Cho et al. (2004). Con el propósito de estimar este valor de concentración, se determinó la relación del control (Rt). 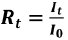 , Rt: para compensar la pérdida natural de la luz, I0: luminiscencia inicial del control e It: luminiscencia del control transcurrido en un tiempo t.
, Rt: para compensar la pérdida natural de la luz, I0: luminiscencia inicial del control e It: luminiscencia del control transcurrido en un tiempo t.
G se relaciona con la concentración del tóxico mediante la siguiente función exponencial: 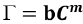 , Ӷ: factor gamma, b y m: parámetros que caracterizan la función, C: concentración del tóxico. El factor gamma se calculó mediante
, Ӷ: factor gamma, b y m: parámetros que caracterizan la función, C: concentración del tóxico. El factor gamma se calculó mediante 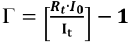 . Para calcular los valores de EC50, se linealizaron los datos aplicando una transformación logarítmica:
. Para calcular los valores de EC50, se linealizaron los datos aplicando una transformación logarítmica: 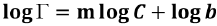 , cuando G = 1, C es equivalente a la EC50.
, cuando G = 1, C es equivalente a la EC50.
Procesamiento de datos
Para el procesamiento estadístico de los datos, se aplicó un análisis de varianza de clasificación simple, con un coeficiente de significación del 95% y la prueba de comparación de medias de rangos múltiples de Duncan (Lerch, 1977). Las curvas de pérdida de la luminiscencia, en función de la concentración del xenobiótico, se ajustaron a una función exponencial negativa y = Ae – Bx + C y se tomó el χ2 como un indicador de la calidad del ajuste. El procesamiento se llevó a cabo con el programa OriginPro (2024).
A la hora de caracterizar las curvas, se tomaron en cuenta la pendiente del segmento lineal de la curva exponencial y la extensión del fenómeno estudiado con base en el valor alcanzado para altas concentraciones del tóxico. Estos parámetros permitieron comparar cuantitativamente el efecto de los diferentes compuestos sobre la luminiscencia.
Las determinaciones se realizaron por triplicado y los resultados se expresan en términos de la media ± desviación estándar (DE). Los resultados fueron procesados con los programas: OriginPro (2024) y Excel (2018).
En el desarrollo de esta investigación, se demostró la disminución que ocasionan xenobióticos de diferente complejidad y naturaleza química sobre la luminiscencia de tres cepas de V. harveyi (CBM-784, CBM-976 y CBM-992) aisladas de aguas de la plataforma cubana.
El perfil de pérdida de la luminiscencia en función de la concentración del xenobiótico resulta similar para los compuestos estudiados. En la medida en que aumenta la concentración del xenobiótico (sales de metales y pesticidas) en el medio, se produce una disminución de la luminiscencia emitida por la bacteria (Figs. 1 y 2). Los ajustes de los datos a una función exponencial negativa fueron satisfactorios, ya que sus bondades de ajuste (χ2) resultaron entre 0.92 y 0.99. El análisis de las pendientes del segmento recto de la caída de la luz, en función de la concentración, mostró que disminuir la luminiscencia inicial fue diferente en dependencia de la naturaleza del compuesto de que se trate (Cuadro 1).
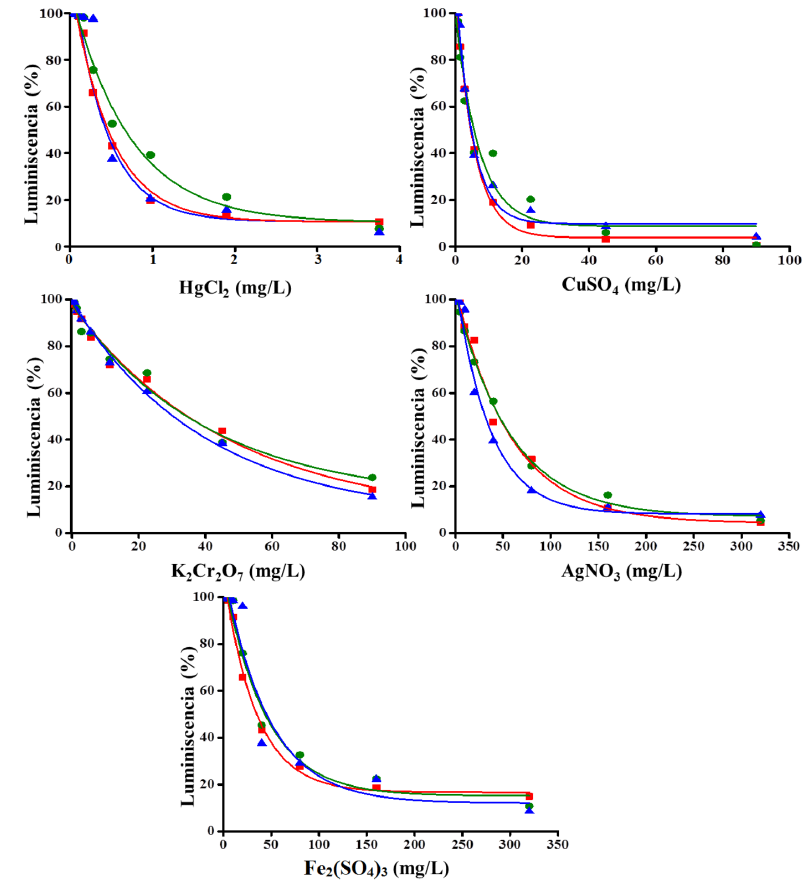
Fig. 1. Influencia de diferentes concentraciones de sales de metales sobre la intensidad de la luminiscencia de las cepas de V. harveyi, a los 15 min de exposición. Los puntos de las gráficas representan el valor promedio de tres réplicas experimentales independientes. La variabilidad de los resultados se expresó como la desviación estándar de la media y fue, en todos los casos, menor de un 10% del valor principal. No se representa, para una mayor claridad de la figura. Las curvas se ajustaron a una función exponencial negativa, mediante Origin Pro (2024). Los valores de bondad de ajuste (χ2) oscilaron entre 0.92-0.99. Rojo: V. harveyi CBM-784; verde: V. harveyi CBM-976; y azul: V. harveyi CBM-992
Fig. 1. Influence of different concentrations of metal salts on the luminescence intensity of the isolates, at 15 min of exposure. Dots in the graphs represent the average value of three independent experimental replicates. The variability of the results was expressed as the standard deviation of the mean and was, in all cases, less than 10% of the principal value. It is not plotted for clarity of the figure. Curves were fitted to a negative exponential function using Origin Pro (2024). Goodness-of-fit (χ2) values ranged from 0.92-0.99. Red: V. harveyi CBM-784, green: V. harveyi CBM-976, and blue: V. harveyi CBM-992
Cuadro 1. Comparación de las pendientes de la zona recta de las curvas de evolución de la luminiscencia de V. harveyi CBM-784, CBM-976 y CBM-992 frente a los xenobióticos ensayados. Letras distintas indican diferencias estadísticas entre los valores (P < 0.05; ANOVA y prueba de rangos múltiples de Duncan)
Table 1. Comparison of the slopes of the straight zone of the luminescence evolution curves of V. harveyi CBM-784, CBM-976, and CBM-992 against the tested xenobiotic. Using various letters indicates statistical differences between values (P < 0.05; ANOVA and Duncan’s multiple range test)
|
CBM-784 |
CBM-976 |
CBM-992 |
|
|
HgCl2 |
-228.3 a ± 8.2 |
-159.4 a ± 7.1 |
-189.6 a ± 5.7 |
|
CuSO4 |
-13.3 b ± 1.8 |
-13.0 b ± 2.8 |
-17.6 b ± 2.0 |
|
K2Cr2O7 |
-3.2 c ± 0.9 |
-2.9 c ± 0.9 |
-3.1 c ± 1.0 |
|
AgNO3 |
-1.7 c ± 0.4 |
-1.2 c ± 0.6 |
-2.2 c ± 0.5 |
|
FeSO4 |
-1.9 c ± 0.3 |
-2.0 c ± 0.4 |
-2.2 c ± 0.2 |
|
Cuproflow |
-14.3 b ± 1.8 |
-13.4 b ± 1.1 |
-19.0 b ± 2.1 |
|
Kospi-sc 130 |
-1.2 c ± 0.5 |
-1.6 c ± 0.3 |
-1.7 c ± 0.7 |
|
Envidor |
-1.4 c ± 0.3 |
-1.3 c ± 0.2 |
-1.2 c ± 0.4 |
|
Sphere Max |
-2.2 b ± 0.8 |
-1.4 b ± 0.8 |
-1.9 b ± 0.3 |
La caracterización de las curvas de la pérdida de la luminiscencia, en función de la concentración de HgCl2 evidenciada a través de las pendientes (Cuadro 1) y el alcance (aproximadamente 85% de pérdida de la luminiscencia) (Fig. 1), no mostró diferencias estadísticamente significativas entre las respuestas de las tres cepas de V. harveyi.
La sal de Cu mostró una efectividad equivalente en la pérdida de la luminiscencia de las tres cepas, como lo refleja la similitud de las pendientes de los segmentos rectos de las exponenciales (Cuadro 1). Al comparar los resultados correspondientes a la sal de Cu con los de Hg, se observó que la pendiente de estos últimos es 20 veces mayor (Cuadro 1). Por otra parte, la disminución de la luminiscencia en un 85% para el CuSO4 se alcanza a una concentración aproximadamente 20 veces menor que la del HgCl2 (Fig. 1), por lo que el Cu resulta menos tóxico que el Hg para estas cepas de bacterias luminiscentes.
Las sales de Cr, Ag y Fe muestran, también, el comportamiento exponencial negativo ya descrito (Fig. 1). Las pendientes de los tres xenobióticos no mostraron diferencias entre las cepas estudiadas. Los valores calculados de las pendientes resultaron dos órdenes menores que para el HgCl2 y un orden menor que en el caso del CuSO4 (Cuadro 1). Al analizar el alcance de la pérdida de la luminiscencia, se observó que la caída de un 85% de la emisión se obtuvo a 90 mg/L para el dicromato, entre 100 y 160 mg/L para la plata y a valores superiores a 175 mg/L para el Fe (Fig. 1). En su conjunto, estos resultados sitúan a la sal de Hg como la más tóxica frente a las tres cepas de V. harveyi.
Los pesticidas Cuproflow, Sphere Max, Kospi-sc 130 y Envidor provocaron una disminución de la luminiscencia de las tres cepas, en función de la concentración (Fig. 2), con un perfil similar a lo descrito para las sales de los metales (Fig. 1). Se obtuvieron ajustes adecuados a una función exponencial negativa con valores de χ2 entre 0.93 y 0.99. No se observaron diferencias significativas entre las pendientes de las zonas rectas para los pesticidas entre las tres cepas (Cuadro 1). La mayor pendiente de caída de la luminiscencia se registró para Cuproflow (Cuadro 1); lo que es consistente con la menor concentración requerida para obtener una disminución de un 85% de la luminiscencia, al compararlo con los otros tres pesticidas (Fig. 2).
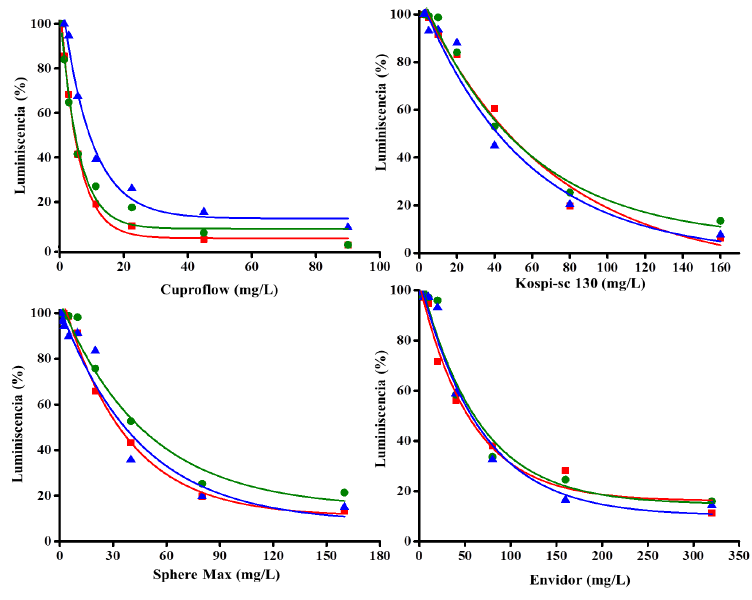
Fig. 2. Influencia de diferentes concentraciones de los pesticidas sobre la intensidad de la luminiscencia de los aislados, a los 15 min de exposición. Los puntos de las gráficas representan el valor promedio de tres réplicas experimentales independientes. La variabilidad de los resultados se expresó como la desviación estándar de la media y fue, en todos los casos, menor de un 10% del valor principal. No se representa para una mayor claridad de la figura. Las curvas se ajustaron a una función exponencial negativa mediante Origin Pro (2024). Los valores de bondad de ajuste (χ2) oscilaron entre 0.92-0.99. Rojo: V. harveyi CBM-784; verde: V. harveyi CBM-976; y azul: V. harveyi CBM-992
Fig. 2. Influence of different concentrations of pesticide on the luminescence intensity of the isolates, at 15 min of exposure. The dots in the graphs represent the average value of three independent experimental replicates. The variability of the results was expressed as the standard deviation of the mean and was, in all cases, less than 10% of the main value. It is not plotted for clarity of the figure. Curves were fitted to a negative exponential function using Origin Pro (2024). Chi-Square Goodness-of-fit (χ2) values ranged from 0.92-0.99. Red: V. harveyi CBM-784, green: V. harveyi CBM-976, and blue: V. harveyi CBM-992
La EC50 de los nueve compuestos tóxicos, calculada a partir de la disminución de la luminiscencia de las cepas de V. harveyi CBM-784, CBM-976 y CBM-992, se muestra en el Cuadro 2. No se encontraron diferencias significativas entre los valores de EC50 para los diferentes tóxicos, entre las tres cepas estudiadas. Una vez demostrado que no existían diferencias significativas entre las tres cepas, se calcularon las EC50 promedio para todos los tóxicos (Cuadro 2).
Cuadro 2. Valores estimados de EC50 de las cepas de bacterias luminiscentes, basados en la atenuación de la intensidad de la luminiscencia a los 15 min de exposición a los xenobióticos ensayados. Letras distintas indican diferencias estadísticas entre los valores (P < 0.05; ANOVA y prueba de rangos múltiples de Duncan)
Table 2. Estimated EC50 values of luminescent bacterial strains, based on the decreased luminescence intensity at 15 min of exposure to the tested xenobiotics. Using various letters indicates statistical differences between values (P < 0.05; ANOVA and Duncan’s multiple range test)
|
Tóxico |
EC50 a 15 min (mg/L) |
|||
|
CBM-784 |
CBM-976 |
CBM-992 |
Promedio |
|
|
HgCl2 |
0.43f ± 0.11 |
0.51g ± 0.08 |
0.39d ± 0.12 |
0.44 ± 0.10 |
|
CuSO4 |
9.28e ± 4.75 |
11.83f ± 3.27 |
8.81c ± 1.69 |
9.97 ± 3.22 |
|
Cuproflow |
10.56e ± 0.29 |
10.54f ± 0.65 |
9.52c ± 0.25 |
10.21 ± 0.59 |
|
K2Cr2O7 |
28.6d ± 2.31 |
29.04e ± 2.98 |
33.44b ± 3.90 |
30.36 ± 2.68 |
|
Sphere Max |
37.92c ± 4.31 |
36.81d ± 6.97 |
36.33b ± 6.29 |
37.02 ± 6.11 |
|
Kospi-sc 130 |
36.18c ± 5.78 |
44.92c ± 6.38 |
38.73b ± 3.14 |
39.94 ± 5.19 |
|
Fe2(SO4)3 |
47.36b ± 8.82 |
47.36c ± 5.13 |
43.81a ± 0.37 |
46.18 ± 2.04 |
|
AgNO3 |
61.55a ± 5.09 |
60.03b ± 8.36 |
41.08ab ± 3.01 |
54.22 ± 5.42 |
|
Envidor |
69.64a ± 2.45 |
76.51a ± 6.51 |
48.44a ± 2.84 |
64.86 ± 3.93 |
Como se puede observar en el Cuadro 2, el HgCl2 fue el compuesto que mostró el menor valor de la EC50 (0.44 ± 0.06 mg/L), lo que indica que fue el más tóxico, seguido, en orden descendente de toxicidad, por el CuSO4 (9.97 ± 1.62 mg/L), este último muy similar al Cuproflow (10.21 ± 0.59 mg/L), un pesticida que contiene Cu (oxicloruro) en su composición, ambos unas 20 veces menos tóxicos que el HgCl2. Por su parte, el dicromato de potasio (30.36 ± 2.68 mg/L) es unas 70 veces menos tóxico que el HgCl2; mientras el Sphere Max (37.02 ± 0.81 mg/L) fue muy similar en toxicidad al Kospi sc-130 (39.94 ± 4.49 mg/L), alrededor de 90 veces menos tóxicos que el HgCl2. Siguen, en orden descendente, el Fe2(SO4)3 (46.18 ± 2.04 mg/L) y la sal de Ag (54.22 ± 11.40 mg/L), menos tóxicos que el HgCl2 entre 100 y 120 veces, respectivamente. Por último, el Envidor resultó el menos tóxico (64.86 ± 14.63 mg/L) de todos los agentes evaluados (Cuadro 2).
Para evaluar el impacto de contaminantes, en ecosistemas marinos y terrestres, lo adecuado es realizar tanto análisis físico-químicos como toxicológicos. Los primeros no dan información sobre la toxicidad de las muestras ambientales, ya que no toman en cuenta la interacción entre los xenobióticos y los sistemas vivos. Por su parte, los segundos son más laboriosos y requieren un equipamiento altamente costoso y especializado (de la Gala Morales, 2014; Mahendran et al. 2022). Por dichas razones, los ensayos microbianos han sido ampliamente utilizados en los tamizajes de toxicidad. La similitud entre las funciones bioquímicas básicas de los organismos procariontes y eucariontes, su facilidad de manipulación, el corto tiempo de exposición necesitado por el agente evaluado y la reproducibilidad de los resultados interlaboratorios estimulan el empleo de bacterias luminiscentes en el monitoreo de la calidad ambiental (Axelrod et al. 2016).
El mecanismo de emisión de luz presente en algunas especies bacterianas es sensible a xenobióticos, por lo que se han utilizado en pruebas ecotoxicológicas para evaluar la calidad de ambientes acuáticos (Perego et al. 2002; López-Roldan et al. 2012; Girotti et al. 2015; Vega-Corrales & Marín-Vindas, 2021). En este trabajo, se examinó el impacto de diferentes xenobióticos sobre la luminiscencia de tres cepas de V. harveyi aisladas de ecosistemas marinos cubanos. Las tres cepas de bacterias mostraron una reducción similar en la emisión luminiscente frente a las sales de metales (Fig. 1) y pesticidas (Fig. 2). Esta similitud pudiera explicarse por ser la misma especie y provenir del mismo ecosistema.
El mercurio es uno de los elementos tóxicos más abundantes en la naturaleza (Jan et al. 2016) y se encuentra entre los metales cuyos efectos adversos se encuentran mejor documentados (Vishnivetskaya et al. 2011; Ayangbenro & Babalola, 2017). El Hg puede bioacumularse en el humano, principalmente por el consumo de mariscos, pescado, crustáceos, etc., y puede ocasionar daños al estado de salud. En la naturaleza, el Hg está desigualmente distribuido en el medio marino y existe en tres formas químicas: Hg elemental (Hg0 metálico), Hg inorgánico (como sales de Hg+ y Hg2+) y Hg orgánico (CH3Hg+, etc.) (Chen & Dong, 2022).
El Hg se une a grupos sulfhidrilos e incapacita a enzimas clave implicadas en múltiples funciones celulares. La entrada del Hg a la célula ocurre a través de proteínas transportadoras de cationes divalentes (Schaefer et al. 2014) o mediante la formación de compuestos divalentes que pueden atravesar la membrana por difusión simple (Liu et al. 2016). En el interior celular, ocasiona un profundo daño; afecta el metabolismo debido a la modificación covalente de enzimas y proteínas, entre ellas, de la enzima luciferasa, responsable de la luminiscencia en bacterias. De ahí que la toxicidad encontrada para el Hg sea la más alta del conjunto de xenobióticos examinados, lo cual se sustenta por los menores valores de EC50 obtenidos para el mercurio (Cuadro 2) y las mayores pendientes que derivan en el curso de pérdida de luminiscencia (Cuadro 1 y Fig. 1). Estos resultados se hallan en el orden de lo informado para la bacteria de origen marino V. fisheri (EC50 = 0.8 mg/L), empleada en el método estándar comercial de MicrotoxR (Cho et al. 2004). De 12 xenobióticos analizados por Cho et al. (2004), que incluían compuestos orgánicos e inorgánicos, el Hg resultó el más tóxico. La mayor toxicidad se informó tanto con la bacteria luminiscente V. fisheri como con la Janthinobacterium lividum YH9-RC modificada, a partir de los genes luxAB, y optimizada para pruebas de toxicidad (Cho et al. 2004).
El cobre es necesario como factor de oxidación en los centros catalíticos de las enzimas. Sin embargo, el cobre libre es un peligro potencial, debido a su alta reactividad química. Por consiguiente, los organismos ejercen un control estricto sobre el transporte y el tráfico de Cu+ a través de los diferentes compartimentos celulares, garantizando la homeostasis necesaria para la prevención de sus potenciales efectos tóxicos. De hecho, las bacterias mantienen un estricto control del Cu libre intracelular, mediante su quelación, por moléculas de alta afinidad y la detección del Cu libre por reguladores transcripcionales. El metal en su forma no asociada puede participar en una serie de reacciones perjudiciales; entre ellas, una de las más notables es la producción de especies reactivas de oxígeno (ROS). Estas son altamente reactivas, producto de la reacción de Fenton y la interferencia con el ensamblaje de la proteína del clúster [Fe-S] (Gaetke & Chow, 2003; Macomber & Imlay, 2009; Dupont et al. 2011). Es muy probable que la generación de estas ROS ocurra en el nivel de la membrana celular, antes que el catión pueda penetrar al interior celular, dados los estrictos mecanismos de control de su ingreso a la célula. El Cu+ en el interior puede generar reacciones químicas que originan ROS, las cuales conducen al daño oxidativo del sistema luciferasa.
Las cepas de V. harveyi CBM-784, CBM-976 y CBM-992 examinadas en este trabajo mostraron una mayor sensibilidad frente al Cu (EC50 9.97 ± 1.62 mg/L, Cuadro 2) que la informada para V. fischeri salvaje (EC50 37.1 ± 7.8 mg/L); sin embargo, la cepa YH9-RC modificada genéticamente exhibió un valor de 9.5 ± 1.5 mg/L (Cho et al. 2004), similar al obtenido en el presente estudio. Por su parte, el Cuproflow, cuyo componente activo es el oxicloruro de cobre (38%), mostró un efecto tóxico (EC50 10.21 ± 0.59 mg/L, Cuadro 2) muy semejante al del CuSO4, lo cual indica que la toxicidad de este producto frente a las cepas es probablemente debido a la presencia del Cu en su composición.
El cromo es un elemento natural presente en la corteza terrestre, en diversas matrices medioambientales tales como el aire, el agua y el suelo. La mayor liberación procede de las industrias de transformación de metales, las curtidurías, la producción de cromatos, la soldadura de acero inoxidable y la producción tanto de ferrocromo como de pigmentos de cromo. Este elemento es liberado al medio ambiente, más que todo en forma hexavalente (Cr6+) (Tchounwou et al. 2012). En particular, el Cr6+ se ha asociado con la aparición de una serie de patologías, mientras el Cr3+ es necesario para el metabolismo en cantidades traza de lípidos y proteínas, así como cofactor para la acción de la insulina (Fang et al. 2014; Balali-Mood et al. 2021). Los mecanismos de interacción entre el cromo y los sistemas biológicos son poco conocidos, aunque la toxicidad del Cr6+ se ha adjudicado a la facilidad con que puede atravesar las membranas celulares y su posterior reducción intracelular a intermediarios muy reactivos. El Cr6+ puede ingresar al interior celular por medio del transportador de sulfato del cual constituye un inhibidor competitivo (Gutiérrez-Corona et al. 2010). Muchos de sus efectos patológicos están relacionados con la generación de ROS, la inactivación de enzimas y la supresión de la defensa antioxidante (Balali-Mood et al. 2021). El daño al ADN, la inestabilidad genómica y la generación de ROS son considerados mecanismos de toxicidad y carcinogenicidad del Cr. La generación de ROS promueve el estrés oxidativo celular, así que interrumpe un conjunto de funciones metabólicas, entre las cuales se puede encontrar el sistema luciferín-luciferasa bacteriano. El valor de toxicidad promedio del Cr determinado mediante la EC50 fue de 30.36 ± 2.68 mg/L (Cuadro 2), muy superior a los informados por Cho et al. 2004 (EC50 = 17.2 ± 2.4 mg/L) para la cepa salvaje de V. fischeri y para la cepa de J. lividum (YH9-RC) modificada con los genes luxAB (EC50 = 7.5 ± 2.2 mg/L).
El hierro es uno de los metales trazas más importantes para la vida. Actúa como cofactor de enzimas disímiles que intervienen en procesos metabólicos esenciales como: la respiración, la fotosíntesis, la fijación de nitrógeno, la metanogénesis, el ciclo de la ácidos tricarboxílicos, el transporte de oxígeno y la regulación génica (Mackenzie et al. 2008). Una de las estrategias del género Vibrio para la internalización de Fe3+ la constituye la producción de sideróforos, compuestos de pequeña masa molecular que presentan una alta afinidad por este metal (de Carvalho, & Fernandes, 2010; Westrich, 2015). Los sideróforos son secretados al medio externo y forman complejos solubles con el Fe3+, los cuales se reincorporan al interior celular a través de receptores específicos (Braun & Hantke, 2007). Otro mecanismo descrito en bacterias Gram negativas para el transporte de hierro lo conforma la familia de proteínas OFeT (oxidasas dependientes de Fe2+); el complejo proteico reduce Fe3+ a Fe2+ y este último es oxidado e internalizado por su receptor en membrana (Grass, 2007). Sin embargo, aunque el hierro es esencial, también puede resultar tóxico, debido a que podría producir especies reactivas de oxígeno, con posibilidad de afectar los ácidos nucleicos, los lípidos y las proteínas.
Las elevadas concentraciones extracelulares de Fe que superan los mecanismos homeostáticos de la bacteria pudieran inducir toxicidad mediante la estimulación de los procesos generadores de ROS, lo que podría ser la causa de la inhibición o reducción de la emisión luminiscente. En los últimos años, se ha informado un aporte de partículas de hierro a niveles tóxicos hacia el mar, como consecuencia del desarrollo urbano e industrial (Ayangbenro & Babalola, 2017).
En nuestro trabajo, el hierro es el elemento que siguió, en orden descendente de toxicidad, al Cr. La EC50 promedio para las tres cepas fue 46.18 ± 2.04 mg/L, alrededor de 100 veces menos tóxico que el Hg, 5 veces menos que el Cu y 1.5 veces menos que el Cr (Cuadro 2). El valor promedio de EC50 obtenido (46.18 ± 2.04 mg/L, Cuadro 2) como resultado de la exposición de las tres cepas al hierro fue similar a los informados por López-Roldan et al. 2012, al evaluar la toxicidad acuática in situ mediante una cepa de V. fisheri (52.08 ± 5.4 mg/L). En contraste, el valor promedio de la EC50 del presente estudio se encuentra tres veces por encima de la EC50 (16.5 ± 0.9 mg/L) reportada por Cho et al. (2004), por lo que la cepa de V. fisheri empleada por estos autores resulta más sensible que aquellas de V. harveyi CBM-784, CBM-976 y CBM-992.
La plata es un metal ampliamente explotado en la metalurgia, en la joyería y la medicina (Coutiño-Rodríguez & Pérez-Gutiérrez, 2007). Uno de los mecanismos mediante los cuales se internaliza la plata es el transporte, a través de las porinas (Marrero & Fando, 2009; Zarubina et al. 2015), por lo que pudiera plantearse que la toxicidad de este elemento está limitada por el paso a través de la proteína transportadora transmembrana y el efecto se magnifica cuando el catión se acumula en el citosol celular.
La entrada de los iones Ag+ al citosol de las bacterias y la consecuente interacción con las proteínas del complejo luciferin-luciferasa, así como la posible generación de estrés oxidativo mediado por las ROS pueden causar una rápida inhibición/atenuación a la hora de emitir luz.
Para las cepas de V. harveyi CBM-784, CBM-976 y CBM-992, los iones Ag+ mostraron un valor promedio de EC50 (54.22 ± 11.40 mg/L, Cuadro 2) similar al encontrado para el Fe3+ (46.18 ± 2.05), lo cual pudiera reflejar la similitud en los mecanismos básicos de citotoxicidad, en los que están involucrados ambos metales. El valor promedio de EC50 para AgNO3 se encuentra en el mismo orden del obtenido por Futra et al. (2014) (60.0 mg/L), al evaluar la efectividad de un biosensor desarrollado a partir de Allivibrio fischeri immobilizada en microesferas de alginato. Sin embargo, Wie et al (2012), cuando emplearon una cepa V. fischeri, informaron valores de EC50 < 2 mg/L, significativamente inferiores. Esto pudiera atribuirse a las diferencias entre las especies bacterianas empleadas y a los ajustes de las condiciones experimentales de los estudios.
Atendiendo a los valores de EC50 de las sales de metales, la secuencia registrada fue coincidente en las tres cepas de bacteria (Hg2+ > Cu2+ > Cr6+ > Ag+ ≈ Fe3+), aun cuando presentaron variaciones en su magnitud (Cuadro 2). El orden descendente de toxicidad coincide con los reportados por Futra et al. (2014) (Cu2+ > Cr6+ > Ag+ > Fe3+) lo que, en cierta medida, valida los resultados aquí descritos.
Además de las sales de metales, en este trabajo se evaluaron los pesticidas Cuporflow, Sephere Max, Kospi-sc 130 y Envidor, ampliamente utilizados en la agricultura. El Cuproflow mostró la mayor toxicidad, entre todos los plaguicidas ensayados, como lo indica la mayor inhibición de la luminiscencia, en función de la concentración (Fig. 2, Cuadro 2). El oxicloruro de cobre (Cu+/Cu2+) presente en Cuproflow actúa perturbando las membranas de los hongos y las bacterias, por lo cual evita su reproducción y facilita la aparición de enfermedades derivadas de ellos. Esta acción posiblemente se complemente con la inducción de ROS conducentes al estrés oxidativo que puede conllevar la muerte celular. La presencia del Cu en Cuproflow parece ser el responsable de su actividad tóxica.
Kospi-sc 130 es un insecticida compuesto de Bifentrina e Imidacloprid. La Bifenetrina perturba el equilibrio Na+/K+, por lo que se interrumpe la conducción de los impulsos nerviosos que llevan a la parálisis y a la muerte; por su parte, el Imidacloprid bloquea los receptores a la acetilcolina de tipo nicotínico, por lo que obstaculiza el funcionamiento del sistema nervioso (ROTAM Agro Colombia S. A. S., www.ghcia.com.co/plm/source/productos/10006_58_168.htm). Kospi-sc es un producto diseñado para el empleo en organismos eucariontes cuya diana es el sistema nervioso. Por ello, es de esperar que su toxicidad en bacterias sea relativamente baja, cuando se compara con los agentes metálicos estudiados que operan por mecanismos oxidativos más universales (Cuadro 2). Sin embargo, su potencial afectación a la salud humana o al entorno hizo recomendable incluirlo en la investigación.
Sphere Max es un fungicida desarrollado para la agricultura. Sus ingredientes activos son Trifloxistrobin y Cyproconazol. El Trifloxystrobin inhibe la germinación de esporas y el desarrollo micelial en las plantas. Cyproconazol actúa sobre los hongos patógenos y detiene el crecimiento de sus membranas celulares. Este compuesto inhibe la síntesis del ergosterol y afecta la respiración mitocondrial, por lo que tiene un efecto inhibidor de la germinación de las esporas del patógeno (Bayer Crop Science Argentina, https://cropscience.bayer.com.ar/sphere-max-soja). De manera análoga a lo descrito para el Kospi-sc 130, la toxicidad de Sphere Max frente a las cepas de V. harveyi CBM-784, CBM-976 y CBM-992 fue relativamente baja (Cuadro 2).
Por su lado, Envidor es un acaricida destinado a la agricultura, cuyo principio activo es: 3-(2,4-dichlorophenyl)-2-oxo-1-oxaspiro[4.5]dec-3-en-4-yl 2,2-dimethylbutanoate. Su acción está basada en la interferencia del metabolismo de los lípidos, al actuar en calidad de inhibidor de la acetil-coenzima A carboxilasa. Adicionalmente, Envidor induce daños al ADN, así como en los ovarios de los insectos (González-Marín et al. 2023). Este plaguicida fue el que mostró una menor toxicidad entre todos los estudiados frente a las bacterias luminiscentes.
Hasta donde sabemos, este es el primer reporte de la toxicidad de Cuproflow, Envidor, Kospi-sc 130 y Sphere Max ante bacterias luminiscentes, por lo que estas evaluaciones resultan novedosas. De acuerdo con la EC50, el orden de toxicidad resultó: Cuproflow > Sphere Max ≈ Kospi-sc 130 > Envidor (Cuadro 2). En términos generales, las cepas V. harveyi CBM-784, CBM-976 y CBM-992 mostraron buena sensibilidad a los compuestos evaluados y la secuencia de toxicidad expuesta por las cepas ante los compuestos evaluados fue: HgCl2 > CuSO4 ≈ Cuproflow > K2Cr2O7 > Sphere Max ≈ Kospi-sc 130 > Fe2(SO4)3 > AgNO3 > Envidor. Los resultados del presente trabajo se encuentran en el mismo orden de toxicidad que los informados por otros autores y, por tanto, sustentan el concepto de que las tres cepas de V. harveyi pueden ser empleadas en un potencial biosensor para el monitoreo de la calidad ambiental.
Las cepas de V. harveyi CBM-784, CBM-976 y CBM-992, aisladas de las aguas pertenecientes a la plataforma marina cubana, mostraron una sensibilidad similar frente los xenobióticos estudiados, determinada a partir de la pérdida de su luminiscencia.
Los valores de EC50 permitieron establecer un orden de toxicidad, tanto para sales de metales como para los pesticidas empleados en la agricultura. Esto sustenta la posibilidad de utilizar estas cepas, en la implementación de un biosensor para la evaluación de contaminación en diversos ecosistemas.
Al Programa Sectorial de Ciencia, Tecnología e Innovación: Uso sostenible de los componentes de la Diversidad Biológica en Cuba, por el financiamiento para la ejecución de los proyectos “Empleo de bacterias luminiscentes para la detección de xenobióticos en la zona costera cubana” (2016-2019) y “Diseño de un bioensayo para la detección de contaminantes en ecosistemas marinos mediante tres bacterias luminiscentes de la especie V. harveyi” (2022-2024). Igualmente, se agradece a las personas revisoras y editoras, por contribuir a mejorar la versión final del trabajo.
Axelrod, T., Eltzov, E. & Marks, R. S. (2016). Bioluminescent bioreporter pad biosensor for monitoring water toxicity. Talanta 149, 290-297. https://doi.org/10.1016/j.talanta.2015.11.067
Ayangbenro, A. S. & Babalola, O. O. (2017). A new strategy for heavy metal polluted environments: A review of microbial biosorbents. Int. J. Environ. Res. Public Health, 14(94), 1-16. https://doi.org/10.3390/ijerph14010094
Balali-Mood, M., Naseri, K., Tahergorabi, Z., Khazdair, M. R. & Sadeghi, M. (2021). Toxic Mechanisms of Five Heavy Metals: Mercury, Lead, Chromium, Cadmium, and Arsenic. Front. Pharmacol., 13(13), 643972. https://doi.org/10.3389/fphar.2021.643972
Baumann, P. & Baumann, L. (1981). The marine Gram-negative eubacteria: genera Photobacterium, Beneckea, Alteromonas, Pseudomonas, & Alcaligenes. The Prokaryotes. A handbook on habitats, isolation, & identification of bacteria. Berlin. Springer-Verlag.
Braun, V. & Hantke, K. (2007). Acquisition of Iron by Bacteria. En D. H. Nies, S. Silver (Eds.), Molecular Microbiology of Heavy Metals (pp. 189-219). Berlin: Springer.
Beh, W. C., Lim, Y. K., Asmat, A., Lee, Y. H. & Salmijah, S. (2010). The potential of luminescent Bacteria “Photobacterium leiognathi” as biosensor for the detection of aquatic toxicity. Environ. Nat. Res. J., 8(3), 1-9.
Bolelli, L., Ferri, E. N. & Girotti, S. (2016). The management and exploitation of naturally light-emitting bacteria as a flexible analytical tool: A tutorial. Anal. Chim. Acta., 934, 22-35. https://doi.org/10.1016/j.aca.2016.05.038
Boynton, L. (2009). Using bioluminescent bacteria to detect water contaminants. J. U.S. SJWP., 4, 29-41.
Camanzi, L., Bolelli, M., Maiolini, E., Girotti, S. & Matteuzzi, D. (2011). Optimal conditions for stability of photoemission and freeze drying of two luminescent bacteria use in a biosensor. Environ. Toxicol. Chem., 30(4), 801-805. https://doi.org/10.1002/etc.452
Chen, B. & Dong, S. (2022). Mercury Contamination in Fish and Its Effects on the Health of Pregnant Women and Their Fetuses, and Guidance for Fish Consumption-A Narrative Review. Int. J. Environ. Res. Public Health, 19(23), 15929. https://doi.org/10.3390/ijerph192315929
Cho, J.-C., Park, K.-J., Ihmb, H.-S., Park, J.-E., Kim, S.-Y., Kang, I., … & Kim, S.-J. (2004). A novel continuous toxicity test system using a luminously modified freshwater bacterium. Biosens Bioelectron., 20(2), 338-44. https://doi.org/10.1016/j.bios.2004.02.001
Coutiño-Rodríguez, E. Md. R. & Pérez-Gutiérrez, R. A. (2007). Los compuestos de plata y la salud. Salud Comunidad, 3(5), 29-38.
de Carvalho, C. C. C. R. & Fernandes, P. (2010). Production of metabolites as bacterial responses to the marine environment. Mar. Drugs., 8(3), 705-727. https://doi.org/ 10.3390/md8030705
de la Gala Morales, M. (2014). Desarrollo y aplicación de nuevas tecnologías analíticas para la determinación de contaminantes ambientales (metales pesados y benzo(a)pireno). (Tesis de doctorado no publicada), Universidad de Extremadura, España.
Dupont, C. L., Grass, G. & Rensing, C. (2011). Copper toxicity and the origin of bacterial resistance-new insights and applications. Metallomics, 3(11), 1109-1118. https://doi.org/10.1039/c1mt00107h
Excel. (2018). Microsoft Corporation. Microsoft Excel. https://office.microsoft.com/excel
Fang, Z., Zhao, M., Zhen, H., Chen, L., Shi, P. & Huang, Z. (2014). Genotoxicity of Tri- and hexavalent Chromium compounds In Vivo and their modes of action on DNA damage In Vitro. PLoS One., 9(8), e103194. https://doi.org/10.1371/journal.pone.0103194
Fernández-Piñas, F., Rodea-Palomares, I., Leganés, F., González-Pleiter, M. & Muñoz-Martín, M. A. (2014). Evaluation of the Ecotoxicity of Pollutants with Bioluminescent Microorganisms. Adv. Biochem. Eng. Biotechnol., (2)145, 65-135. https://doi.org/10.1007/978-3-662-43619-6_3
Futra, D., Heng, L. Y., Surif, S., Ahmad, A. & Ling, T. L. (2014). Microencapsulated Aliivibrio fischeri in alginate microspheres for monitoring heavy metal toxicity in environmental waters. Sensors, 14, 23248-23268. https://doi.org/10.3390/s141223248
Gaetke, L. M. & Chow, C. K. (2003). Copper toxicity, oxidative stress, and antioxidant nutrients. Toxicol., 189(1-2), 147-163. https://doi.org/10.1016/S0300-483X(03)00159-8
Girotti, S., Bolelli, L., Ferri, E., Carpené, E. & Isani, G. (2015). Bioindicators in enviromental monitoring: bioluminiscen bacteria, algae and honeybees. Paper presented at the International Conference on Environmental Science and Technology, Greece.
González-Marín, B., Calderón-Segura, M. E. & Sekelsky, J. (2023). Atm/Chk2 and atr/Chk1 pathways respond to dna damage induced by Movento® 240SC and Envidor® 240SC Keto-Enol Insecticides in the Germarium of Drosophila melanogaster. Toxics, 11(9), 754.
https://doi.org/10.3390/toxics11090754
Grass, G. (2007). New transport deals for old Iron. In D. H. Nies & S. Silver. (Eds.), Molecular Microbiology of Heavy Metals. Microbiology Monographs (pp. 221-233). Berlin: Springer. https://doi.org/10.1007/7171_2006_079
Gutiérrez-Corona, J. F., Espino-Saldaña, A. E., Coreño-Alonso, A., Reyna-López, G. E., Acevedo-Aguilar, F. J., Fernández, F. J., ... & Wrobel, K. (2010). Interacciones microbianas con el cromo: mecanismos y potencial biotecnológico. Rev. Latinoamb. Biotecnol Algal., 1(1), 47-63.
Halmi, M. I. E., Kassim, A. & Shukor, M. Y. (2019). Assessment of heavy metal toxicity using a luminescent bacterial test based on Photobacterium sp. strain MIE. Rend. Fis. Acc. Lincei, 30(3), 589-601. https://doi.org/10.1007/s12210-019-00809-5
Hong, G., Antaris, A. L. & Dai, H. (2017). Near-infrared fluorophores for biomedical imaging. Nat. Biomed. Eng., 1, 0010. https://doi.org/10.1038/s41551-016-0010
Jan, A. T., Azam, M., Choi, I., Ali, A. & Haq, Q. M. R. (2016). Analysis for the presence of determinants involved in the transport of mercury across bacterial membrane from polluted water bodies of India. Braz. J. Microbiol., 47(1), 55-62. https://doi.org/10.1016/j.bjm.2015.11.023
Kirsop, B. E. & Doyle, A. (Eds.). (1991). Maintenance of Microorganisms and Cultured Cells: a Manual of Laboratory Methods. 2nd Edition. EE. UU.: Academic Press.
Kurbatska, O. & Orobchenko, O. (2022). Toxicological evaluation of feeds with different levels of heavy metals using luminescent microorganisms Photobacterium рhosphoreum. Scien. Mess. LNU Vet. Med. Biotech. Ser.: Vet. Sci., 24(106), 158-167. https://doi.org/10.32718/nvlvet10624
Lerch, G. (1977). La experimentación en las Ciencias Biológicas y Agrícolas. Cuba.: Editorial Científico Técnica.
Liu, Y.-R., Lu, X., Zhao, L., Jing, A., He, J.-Z., Pierce, E. M., … & Gu, B. (2016). Effects of cellular sorption on mercury bioavailability and methylmercury production by desulfovibrio desulfuricans ND132. Environ. Sci. Technol., 50(24), 13335-13341. https://doi.org/10.1021/acs.est.6b04041
López-Roldan, R., Kazlauskaite, L., Ribo, J., Riva, M. C., González, S. & Cortina, J. L. (2012). Evaluation of an automated luminescent bacteria assay for in situ aquatic toxicity determination. Sci. Total. Environ., 440, 307-313. https://doi.org/10.1016/j.scitotenv.2012.05.043
Mackenzie, E. L., Iwasaki, K. & Tsuji, Y. (2008). Intracellular iron transport and storage: From molecular mechanisms to health implications. Antioxid. Redox. Signal., 10(6), 997-1030. https://doi.org/10.1089/ars.2007.1893
Macomber, L. & Imlay, J. A. (2009). The iron-sulfur clusters of dehydratases are Primary intracelular targets of copper toxicity. Proc. Natl. Acad. Sci. U.S.A., 106, 8344-8349. https://doi:10.1073/pnas.0812808106
Mahendran, G., Savitha, T., Khalifa, A. Y., Sharmae, A. & Sankaranarayanane, A. (2022). Evaluation of environment by microbial sensors. In P. Verma & M. P. Shah (Eds.), Bioprospecting of Microbial Diversity (pp. 407-424). EE. UU.: Elsevier. https://doi.org/10.1016/B978-0-323-90958-7.00010-8
Marrero, K. & Fando, R. (2009). Sistemas de homeostasis del cobre en las bacterias Gram negativas Escherichia coli y Vibrio cholerae. Rev. CENIC Cienc. Biol., 40(3), 186-198.
Martín, A., Serrano, S., Santos, A., Marquina, D. & Vázquez, C. (2010). Bioluminiscencia bacteriana. Reduca (Biología). Ser. Microbiol., 3(5), 75-86.
Muneeswaran, T., Kalyanaraman, N., Vennila, T., Rajesh Kannan, M. & Ramakritinan, C. M. (2021). Rapid assessment of heavy metal toxicity using bioluminescent bacteria Photobacterium leiognathi strain GoMGm1. Environ. Monit. Assess., 193(3), 109. https://doi.org/10.1007/s10661-021-08860-2
OriginPro. (2024). OriginLab Corporation. EE. UU. https://www.originlab.com
Park, J., Shin, K., Lee, H., Choi, S., Kim, G., Depuydt, S., ... & Han, T. (2023). Evaluating ecotoxicological assays for comprehensive risk assessment of toxic metals present in industrial wastewaters in the Republic of Korea. Sci. Total Environ., 1(867), 161536. https://doi.org/10.1016/j.scitotenv.2023.161536
Parvez, S., Venkataraman, C. & Mukherji, S. (2006). A review on advantages of implementing luminescence inhibition test (Vibrio fischeri) for acute toxicity prediction of chemicals. Environ. Int., 32(2), 265-268. https://doi.org/10.1016/j.envint.2005.08.022
Perego, P., Fanara, L., Zilli, M. & Borghi, M. D. (2002). Applications of luminous bacteria on environmental monitoring. Chem. Biochem. Eng. Q., 16(2), 87-92.
Ramteke, P. W., Sagar, A. & Singh, M. P. (2019). Assessment of Wastewater Toxicity by Vibrio fischeri Bioassay. Int. J. Ecol. Env. Sci., 45(1), 15-17.
Sáenz, C. I. & Nevárez, G. V. (2010). La bioluminiscencia de microorganismos marinos y su potencial biotecnológico. Acta Quim. Mex., 2(3), 1-7.
Schaefer, J. K., Szczuka, A. & Morel, F. M. M. (2014). Effect of divalent metals on Hg(II) uptake and methylation by bacteria. Environ. Sci. Technol., 48(5), 3007-30013. https://doi.org/10.1021/es405215v
Tanet, L., Tamburini, C., Baumas, C., Garel, M., Simon, G. & Casalot, L. (2019). Bacterial Bioluminescence: Light Emission in Photobacterium phosphoreum Is Not Under Quorum-Sensing Control. Front. Microbiol., 10(365), 1-9. https://doi.org/10.3389/fmicb.2019.00365
Tchounwou, P. B., Yedjou, C. G., Patlolla, A. K. & Sutton, D. J. (2012). Heavy metal toxicity and the environment. Exp. Suppl., 101, 133-64. https://doi.org/10.1007/978-3-7643-8340-4_6
van der Meer, J. R. & Belkin, S. (2010). Where microbiology meets microengineering: design and applications of reporter bacteria. Nat. Rev. Microbiol., 8(7), 511-22. https://doi.org/10.1038/nrmicro2392
Vega-Corrales, L. & Marín-Vindas C. (2021). Effect of metal concentration on growth and luminescence of luminous bacteria strains isolated from golfo de Nicoya, Costa Rica. Rev. Mar. Cost., 13(1), 27-38. http://dx.doi.org/10.15359/revmar.13-1.2
Vishnivetskaya, T. A., Mosher, J. J., Palumbo, A. V., Yang, Z. K., Podar, M., Brown, S. D., Brooks, S. C., ... & Elias, D. A. (2011). Mercury and other heavy metals influence bacterial community structure in contaminated tennessee streams. Appl. Environ. Microbiol., 77(1), 302-311. http://dx.doi.org/10.1128/AEM.01715-10
Wang, Z., Cong, T. D., Zhong, W., Lau, J. W., Kwek, G., … & Xing, B. (2021). Cyanine-Dyad Molecular Probe for the Simultaneous Profiling of the Evolution of Multiple Radical Species During Bacterial Infections. Angew. Chem. Int. Ed., 60, 16900-16905. https://doi.org/10.1002/anie.202104100
Westrich, J. R. (2015). Consilience of iron in the ecology of vibrio bacteria. (Tesis de Doctorado no publicada), Universidad de Creighton, Georgia.
Wie, M.-A., Oh, S.-J., Kim, S.-C., Kim, R.-Y., Lee, S.-P., Kim, W.-I. & Yang, J.-E. (2012). Toxicity assessment of silver ions compared to silver nanoparticles in aqueous solutions and soils using microtox bioassay. Korean J. Soil Sci. Fert., 45(6), 1114-1119. http://dx.doi.org/10.7745/KJSSF.2012.45.6.1114
Yang, J., Hu, S., Liao, A., Weng, Y., Liang, S. & Ling., Y. (2022). Preparation of freeze-dried bioluminescent bacteria and their application in the detection of acute toxicity of bisphenol A and heavy metals. Food Sci. Nutr., 10(6), 1841-1853. https://doi.org/10.1002/fsn3.2800
Yang, M., Li, J. & Wu, H. (2023). Toxicity evaluation of chlorinated natural water using Photobacterium phosphoreum: Implications for ballast water management. J. Environ. Manage., (335), 11747. https://doi.org/10.1016/j.jenvman.2023.117471
Zarubina, A. P., Deev, L. I., Parkhomenko, I. M., Parshina, E. Y., Sarycheva, A. S., Novoselova, L. A., Lukashev, E. P., … & Rubin, A. B. (2015). Evaluation of toxicity of silver ions and nanoparticles using model bacteria with luminescent phenotype. Nanotechnol. Russi., 10, 475-483. https://doi.org/10.1134/S1995078015030209
1 Instituto de Ciencias del Mar (ICIMAR), calle Loma #14, entre 35 y 37, Plaza de la Revolución, La Habana, Cuba. margarita@icimar.cu*, margarital54@gmail.cu ORCID: https://orcid.org/0000-0001-7517-8063; victoria@icimar.cu ORCID: https://orcid.org/0000-0002-1548-4285; ayamey@icimar.cu ORCID: https://orcid.org/0009-0006-1748-463X; laly@icimar.cu ORCID: https://orcid.org/0000-0001-8043-4076; robertico@icimar.cu ORCID: https://orcid.org/0000-0001-7327-9442; thais@icimar.cu ORCID: https://orcid.org/0009-0002-9058-7716
2 Centro de Estudios de Proteínas (CEP), Facultad de Biología, Universidad de La Habana, calle 25 entre J e I, Plaza de la Revolución, La Habana, Cuba. calvarez@fbio.uh.cu* ORCID: https://orcid.org/0000-0002-9640-3474




