ISSN: 1659-455X • e-ISSN: 1659-407X
Vol. 16 (2), julio-diciembre 2024
Recepción 23 julio 2024 • Corregido 23 noviembre 2024 • Aceptado 21 noviembre 2024
DOI: https://dx.doi.org/10.15359/revmar.16-2.6
 |
Primer reporte de la temporada de anidación de la tortuga verde Chelonia mydas (Testudinata: Cheloniidae) en playa Lagarto, península de Azuero, Panamá First report of the nesting season of the green turtle Chelonia mydas (Testudinata: Cheloniidae) on Lagarto beach, Azuero peninsula, Panama Luisa F. López-Lozano1 & Santiago Jiménez-Arias1 |
RESUMEN
La temporada de anidación de la tortuga verde (Chelonia mydas) del Pacífico panameño está poco estudiada, aunque es un evento crucial para comprender su ecología y contribuir a la conservación de esta especie en peligro de extinción. El presente estudio se centró en caracterizar la actividad de anidación de C. mydas en Playa Lagarto, situada en la península de Azuero. Se realizaron monitoreos nocturnos durante la temporada de anidación comprendida entre diciembre de 2022 y marzo de 2023. Se tomaron datos biométricos de las tortugas anidantes, se les marcó y se realizó un seguimiento de las nidadas. Durante la temporada, se marcaron 15 hembras anidantes, con un promedio de LCC de 91.1 ± 7.0 cm y un ACC de 85.2 ± 6.6 cm. Se documentaron 32 nidadas y las hembras presentaron un éxito de anidación de 31.4%. Se observó una preferencia por anidar en la zona alta con vegetación de la playa, confirmando el comportamiento estándar para esta especie. Se corroboró la relación entre la LCC y la capacidad reproductiva de las hembras anidantes (cantidad de huevos depositados). En cuanto a amenazas para la anidación, un 6.25% de las nidadas fue saqueado por humanos. Dada la escasez de datos relacionados con el comportamiento de anidación de C. mydas en el Pacífico panameño, la información obtenida en este trabajo resulta crucial para conservar la especie en la península de Azuero. Recomendamos seguir con el esfuerzo de monitoreo para estudiar las tendencias de anidación de esta población.
Palabras clave: tortuga verde, playa de anidación, conservación, Pacífico oriental, Panamá.
ABSTRACT
The nesting season of the green turtle (Chelonia mydas) in the Panamanian Pacific is poorly studied, despite being a crucial event for understanding its ecology and contributing to the conservation of this endangered species. The present study aimed to characterize the nesting activity of C. mydas at Playa Lagarto, located on the Azuero Peninsula. Nighttime monitoring was conducted during the nesting season from December 2022 to March 2023. Biometric data was collected from nesting turtles; they were tagged and their nests were monitored. During the season, 15 nesting females were tagged, averaging a CCL of 91.1 ± 7.0 cm and a CCW of 85.2 ± 6.6 cm. A total of 32 nests were documented, and females exhibited a nesting success rate of 31.4%. There was a preference for nesting in the upper zone with beach vegetation, confirming the typical behavior for this species. The relationship between CCL and the reproductive capacity of nesting females (number of eggs laid) was corroborated. Regarding threats to nesting, 6.25% of the nests were poached by humans. Given the scarcity of data related to the nesting behavior of C. mydas in the Panamanian Pacific, the data obtained in this study represents crucial information for the conservation of this species on the Azuero Peninsula. Continuing the monitoring efforts to study nesting trends in this population is recommended.
Keywords: green turtle, nesting beach, conservation, Eastern Pacific, Panama.
La tortuga verde Chelonia mydas (Linnaeus, 1758) es la especie de caparazón duro de mayor tamaño en la familia Cheloniidae (Pritchard & Mortimer, 1999) y se distribuye por todos los océanos tanto tropicales como subtropicales del mundo (Groombridge & Wright, 1982). Frecuentemente, se considera que esta especie se divide en 2 subespecies, debido a sus diferencias morfológicas, geográficas y reproductivas: la tortuga verde del Atlántico (C. mydas mydas) y la del Pacífico Oriental Tropical (POT) (C. mydas agassizii) (Márquez, 1990; Kamezaki & Matsui, 1995; Ministerio de Ambiente de Panamá, 2017). Sin embargo, los análisis y estudios genéticos han invalidado esta subdivisión de especies, y, actualmente, se considera que la población del POT conocida como “tortuga negra” es una unidad de manejo regional con una pigmentación peculiar en su caparazón, en el grupo de C. mydas del Pacífico (Chassin-Noria & Abreu-Grobois, 2002; Naro-Maciel et al. 2008; Camacho-Sánchez et al. 2021).
Durante las últimas 3 generaciones, se ha observado una disminución entre el 48% y el 67% de las hembras anidantes en el nivel global, lo que ha llevado a la tortuga verde a estar en peligro de extinción en la lista roja de la Unión Internacional para la Conservación de la Naturaleza (Seminoff, 2004). No obstante, debido a las acciones de conservación y a las leyes nacionales e internacionales, la tendencia poblacional para esta especie en el POT parece ser ascendente (Seminoff et al. 2015).
La población de tortuga verde en el POT se extiende desde el sur de California hasta Chile y presenta varios sitios de anidación a lo largo de esta distribución (Blanco et al. 2012). Las zonas de anidación con un mayor número de nidadas y hembras anidantes se encuentran en Michoacán (Alvarado-Díaz et al. 2001; Cutzi et al. 2023) y el archipiélago de Revillagigedo (Holroyd & Trefry, 2010) en México, las islas Galápagos en Ecuador (Ministerio de Ambiente del Ecuador, 2014) y Nombre de Jesús e isla San José, en Costa Rica (Fonseca et al. 2018).
El Pacífico de Centroamérica, además de contar con playas de anidación, presenta áreas de alimentación y migración para las tortugas marinas (Heidemeyer et al. 2014; Chacón-Chaverri et al. 2015).La región se considera una de las más peligrosas para esta especie (Hart et al. 2015), la cual se ve afectada, principalmente, por la captura incidental de pesquerías de arrastre, palangre y enmalle (Wallace et al. 2013), la caza furtiva para el consumo de su carne (Blanco et al. 2012) y el tráfico ilegal de sus huevos (CTI, 2020).
En el Pacífico de Panamá, las costas de la península de Azuero son de los lugares con mayor anidación de tortugas marinas en la región (Araúz et al. 2017; Flores et al. 2021). En esta área, se han identificado hembras anidantes y nidadas de tortuga verde en varias playas, incluyendo Mata Oscura (González, 2013), Morrillo (Castillero et al. 2024), El Gato, Cacajilloso, Sandillal, Sierra y Frijoles (Flores et al. 2021). No obstante, la información bibliográfica acerca de los sitios de anidación, alimentación y reproducción de las tortugas marinas en esta zona es muy limitada (Araúz et al. 2017).
En la península de Azuero se encuentra playa Lagarto, en la cual se han realizado investigaciones acerca de la actividad de anidación de la tortuga lora Lepidochelys olivacea (Eschscholtz, 1829) durante su temporada de anidación, que tiene lugar entre julio y diciembre (Garcés et al. 2020; Rodríguez & Contreras, 2020; Lombardo & Saavedra, 2023). Dichos trabajos también han identificado a la tortuga verde como una especie anidante recurrente en esta playa y los autores describen que, durante enero, aumenta la actividad de anidación de tal tortuga. Por lo tanto, el presente estudio pretende caracterizar, específicamente, la temporada de anidación de tortuga verde desde diciembre de 2022 hasta marzo de 2023.
El estudio se llevó a cabo en playa Lagarto (7° 30ʼ 23.51ʼʼ N & 79° 59ʼ 57.92ʼʼ W; Fig. 1) ubicada en la península de Azuero, la cual forma parte del Refugio de Vida Silvestre Pablo Arturo Barrios, en la provincia de Los Santos, Panamá. El área protegida tiene una extensión total de 15 025 ha y cuenta con varios ecosistemas terrestres, fluviales, estuarinos y marino-costeros (Gagné-Landmann, 2017). Debido a su importancia ecológica, fue denominada área protegida en el 2009. La playa mencionada presenta una extensión total de 1.3 km; limita al norte con playa Toro, al sur con playa Lanchón y al este con campos de ganado y residencias privadas. También, hay una desembocadura en el extremo sur y afloramientos rocosos en el extremo norte.
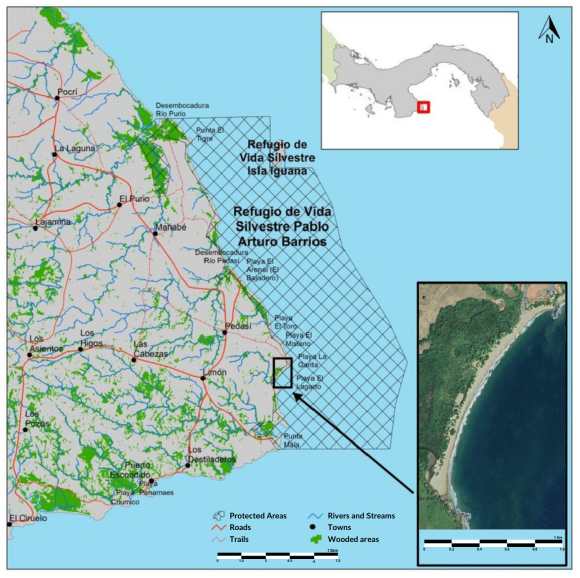
Fig. 1. Ubicación del área de estudio: playa Lagarto (Garcés et al. 2020)
Fig. 1. Location of the study area: Lagarto beach (Garcés et al. 2020)
Se llevaron a cabo monitoreos nocturnos desde diciembre de 2022 a marzo de 2023. Se efectuaron, en total, 80 monitoreos con una duración diaria de 8 horas, que inició a las 21:00. El esfuerzo de monitoreo promedio fue de 640 horas realizadas por 2 investigadores. Los días de los monitoreos se eligieron en función de la fase lunar, así que no se hizo cuando hubo luna llena o nueva, ni los 2 días anteriores y posteriores a dichas fases. Esta decisión se tomó con base en la preconcepción de la comunidad local de que las tortugas verdes no tienden a anidar en estos momentos.
La actividad de anidación se documentó mediante observación directa de los rastros en la playa o el encuentro de una hembra anidante. Todas las actividades en playa fueron clasificadas y numeradas, así como para cada una se tomaron los siguientes datos: fecha, hora del encuentro, especie, regreso/nidada, destino, marea y posición en el perfil de playa.
Se identificó la especie de acuerdo con los rastros de las tortugas, utilizando la guía de Eckert et al. (2000). Los rastros se clasificaron en regresos o nidadas: los primeros correspondieron a recorridos continuos sin anidación o intentos inconclusos (catalogados como “no puso”), mientras que las segundas fueron numeradas y clasificadas según el destino de los huevos. El destino se clasificó como: “in situ”, si los huevos estaban presentes, “desconocido”, si no se observaron, y se realizó un seguimiento posterior para detectar depredación o saqueo por humanos. Además, tanto los rastros como las nidadas fueron borrados para evitar el saqueo de huevos.
Marcaje y toma de datos biométricos
Una vez encontrada una tortuga, se determinó la especie, utilizando la guía de Eckert et al. (2000). Primero, se identificó y se registró si la tortuga presentaba una placa antigua en alguna de las aletas. En el caso de no estar marcada, se colocó una placa Inconel con el número serial desde PY246 hasta PY266, entre la segunda y la tercera escama de la aleta anterior derecha. También, se tomaron medidas del largo curvo del caparazón (LCC) y del ancho curvo del caparazón (ACC). El marcaje y la toma de datos fueron ejecutados después de que la tortuga desovara. En este caso, se contaron los huevos depositados para conocer el tamaño de la nidada.
Tendencias generales de anidación
Se anotó la zona del perfil de playa donde se encontraba el rastro o la nidada: baja (entre marea baja y alta), media (entre marea alta e inicio de vegetación) o alta (después de la vegetación). Al encontrar una hembra anidante, se registró la fase de la marea según la Tabla de Mareas de Punta Mala, Panamá (https://tablademareas.com/pa/oceano-pacifico/punta-mala). Las fases de marea se clasificaron de la siguiente manera: alta (media hora antes o después de la marea alta), baja (media hora antes o después de la marea baja), alta bajando (dos horas después de la marea alta), media bajando (dos horas antes de la marea baja), baja subiendo (dos horas después de la marea baja) y media subiendo (dos horas antes de la marea alta).
Para el análisis de los datos biométricos se aplicó estadística descriptiva, con el fin de observar los promedios de las medidas biométricas (LCC y ACC) y de obtener un promedio del periodo de reanidación, más la cantidad de huevos depositados. Se consiguió el éxito de anidación, tomando en cuenta el número total de nidadas divididas entre el número total de actividades, multiplicado por 100 (Azanza-Ricardo, 2009). Además, se realizó una prueba de chi-cuadrado para evaluar la independencia entre las nidadas observadas y la zona de anidación. Asimismo, se realizó una regresión lineal, con el propósito de determinar si existe un ligamen entre el LCC de las tortugas y los huevos depositados. Los análisis se lograron con un p-value < 0.05, en el programa estadístico RStudio (RStudioTeam, 2020).
Durante la temporada de anidación comprendida entre diciembre de 2022 y enero de 2023, se documentaron un total de 102 actividades de anidación de tortuga verde, de las cuales 32 fueron nidadas y 70 regresos sin anidación exitosa. Se observó la presencia de 2 especies de tortugas marinas; la verde fue la más abundante, seguida por la lora, con 18 actividades de anidación. El pico de actividad de anidación de la tortuga verde durante la temporada fue entre febrero y marzo (Fig. 2).
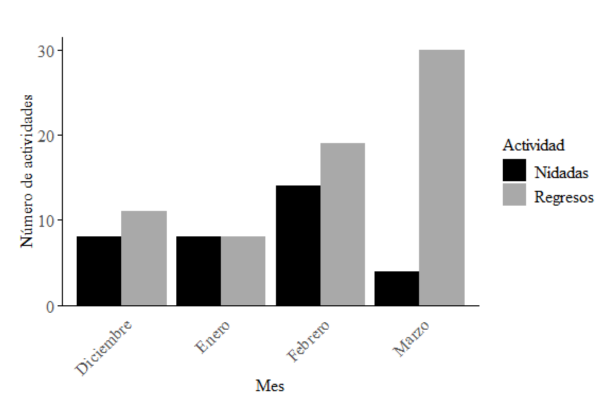
Fig. 2. Actividades de anidación de C. mydas a lo largo de la temporada
Fig. 2. Nesting activities of C. mydas throughout the season
Se documentaron 32 nidadas de tortuga verde con un éxito de anidación de 31.4%. Es destacable un aumento abrupto en la cantidad de regresos documentados para marzo, durante el cual el 46.6% fueron “no puso”. Adicionalmente, se identificó que el 36.3% de los regresos encontrados en la zona alta fueron intentos inconclusos de anidación que se vieron afectados por la pared de erosión creada en distintas zonas de la playa. El resto de los regresos pudieron ser atribuidos a obstáculos presentes o contaminación lumínica; sin embargo, ninguna de estas causas fue estudiada ni se cuantificó su impacto.
Ninguna de las nidadas que fueron borradas durante el monitoreo resultó saqueada. Solamente el 6.25% del total de nidadas fue saqueado por humanos, debido a que se pusieron durante los días sin monitoreo y no pudieron borrarse.
Se encontró un total de 15 hembras anidantes, de las cuales 5 fueron reanidantes, pusieron de 2 hasta 5 nidadas durante la temporada (Fig. 3). También, se observó en repetidas ocasiones cómo otras 6 hembras anidantes emprendieron regresos a lo largo de la temporada. La hembra anidante con número de placa PY252 que fue más veces vista reanidando puso un total de 5 nidadas e hizo 8 actividades de anidación en total. Su periodo de reanidación fue de 13.5 ± 1.7 días. Las hembras anidantes identificadas con las placas PY257 y PY263 fueron contempladas efectuando 3 nidadas cada una, mientras que aquellas con las placas PY250 y PY254 realizaron 2 nidadas. No fue posible calcular los periodos de reanidación de estas hembras, ya que no se observaron de manera consecutiva durante sus reanidaciones.
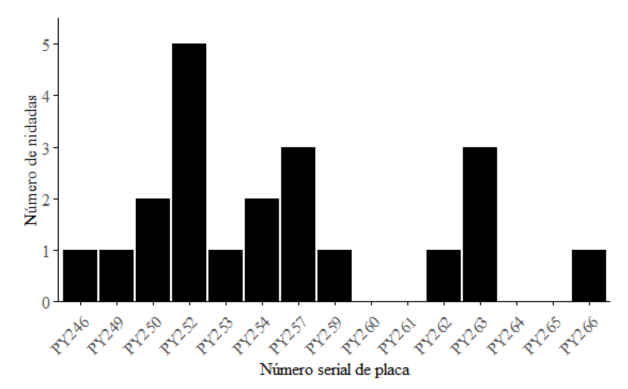
Fig. 3. Frecuencia de anidación de las 15 hembras anidantes marcadas
Fig. 3. Nesting frequency of the 15 tagged nesting females
De las 15 hembras anidantes de tortuga verde, ninguna presentaba, previamente, placas en alguna de sus aletas. Promediaron un LCC de 91.1 ± 7.0 cm (rango de 76.0 a 100.3 cm) y un ACC de 85.2 ± 6.6 cm (rango de 63.1 a 93.0 cm).
La cantidad de huevos depositados por cada hembra varió entre 61 y 121 (promedio de 84.6 ± 22.8). Al comparar el número de huevos con el LCC de cada hembra anidante (Fig. 4), se encontró que las tortugas más grandes, con LCC mayores, tienden a poner más huevos (β = 2.7044, t = 6.871, P < 0.000).
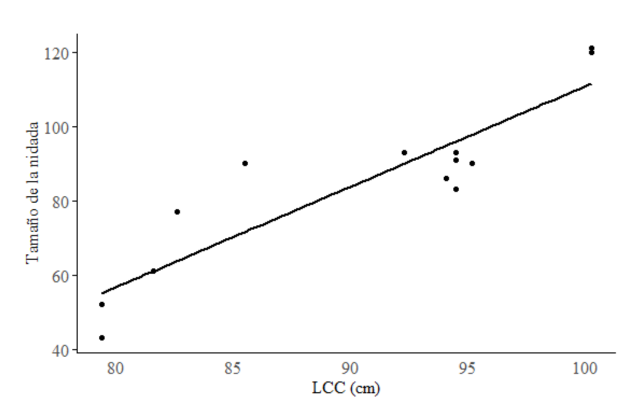
Fig. 4. Regresión lineal entre el LCC y la cantidad de huevos depositados por cada hembra
Fig. 4. Linear regression between CCL and the number of eggs laid by each female
Tendencias generales de anidación
La tortuga verde mostró una clara preferencia por anidar en la zona alta, con presencia de vegetación (chi cuadrado = 26.133, P < 0.000). De las 32 nidadas de esta especie que se localizaron, 31 de ellas fueron puestas en la zona alta y solamente 1 en la zona media. Con respecto a las fases de las mareas, se puede observar que no hubo actividad durante la marea baja ni 2 horas después de esta, así como que la marea con mayor actividad de anidación fue la fase alta bajando (Fig. 5).
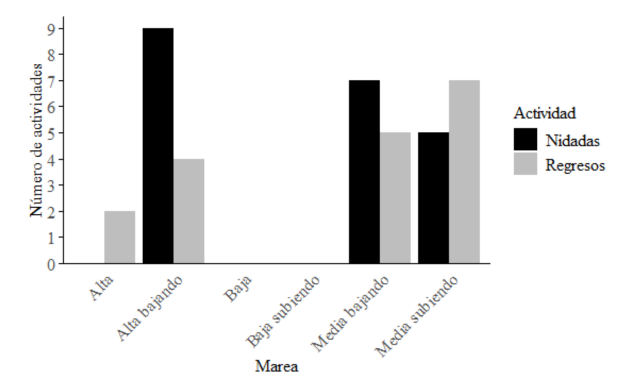
Fig. 5. Actividades de C. mydas en relación con la fase de la marea
Fig. 5. Nesting activities of C. mydas in relation to the tidal phase
Dado que es la primera vez que se estudia la temporada de anidación de la tortuga verde en playa Lagarto, los datos obtenidos representan una aproximación al análisis de la anidación de esta especie en el Pacífico panameño. A partir de la identificación de 15 hembras anidantes y 32 nidadas durante el lapso examinado, se ha observado que la densidad de anidación en la playa estudiada es inferior en comparación con otras playas del POT. Por ejemplo, en Costa Rica, Santidrián-Tomillo et al. (2015) reportaron 126 nidos y 72 tortugas marcadas en un tramo de 1.4 km de playa, mientras que Fonseca et al. (2018) documentaron 1698 nidos y 466 tortugas en tan solo 330 metros de playa.
Pese a la drástica diferencia frente a otras playas, playa Lagarto es de las pocas de anidación que presenta registros de la especie para el Pacífico de Panamá (Garcés et al. 2020; Lombardo & Saavedra, 2023). Además, las recapturas registradas y el caso específico de la tortuga con número de placa PY252 podrían indicar que las tortugas verdes de esta colonia de anidación muestran una posible fidelidad a la playa mencionada (Miller, 1997; Azanza-Ricardo, 2009). Este resultado podría destacar la importancia de tal área para la anidación de la tortuga verde del Pacífico panameño.
Nuestro reporte sobre la temporada de anidación durante la época de verano coincide con lo encontrado en playa El Gato, Panamá, donde la mayoría de los avistamientos de tortugas verdes se han registrado en la época seca, comprendida de diciembre a mayo para el Pacífico de Panamá (Flores et al. 2021). Asimismo, en el archipiélago Murciélago, en Costa Rica, se ha descrito una mayor actividad entre noviembre y febrero, con un pico de anidación en enero (Fonseca et al. 2018).
Respecto al tamaño de las hembras anidantes, los promedios para LCC y ACC registrados fueron similares a lo reportado para esta playa en temporadas anteriores. Garcés et al. (2020) hallaron para la tortuga verde un LCC promedio de 95.6 cm (89.0-107.0 cm) y un ACC promedio de 88.4 cm (82.0 - 98.0 cm). Igualmente, Lombardo y Saavedra (2023) encontraron un LCC de 90.18 ± 7.80 cm (70 - 109 cm) y un ACC de 86.26 ± 6.53 cm (79-104 cm). En comparación con otras colonias de anidación del POT, los promedios encontrados en playa Lagarto fueron relativamente mayores a los de la isla San José (LCC 85.4 ± 5.9 cm, ACC 81.2 ± 4.2 cm; Fonseca et al. 2018), playa Cabuyal, Costa Rica (LCC 86.2 ± 4.7 cm, ACC 80.6 ± 4.9 cm; Santidrián-Tomillo et al. 2015) y Michoacán, México (LCC 85.71 ± 6,83 cm; Cutzi et al. 2023). Además, con las tallas registradas de LCC en el presente estudio y lo descrito por Lombardo y Saavedra (2023), una hembra de tortuga verde ya es sexualmente madura con una talla mínima de 70 a 76 cm de LCC.
Los datos compilados apoyan la hipótesis de que la longitud del caparazón es un predictor de la producción reproductiva en las tortugas. Es decir, se demuestra que la cantidad de huevos puestos aumenta con la LCC de las tortugas verdes (Azanza-Ricardo, 2009), lo cual también ha sido descrito para esta especie en Chipre (Broderick et al. 2003) y Michoacán, México (Cutzi et al. 2023).
Adicionalmente, se descubrió que la estrategia de borrar los rastros y las camas de las nidadas fue efectiva para prevenir el saqueo. En investigaciones previas de la zona de estudio, se encontró que el 68% de las nidadas registradas durante la temporada de anidación de tortuga lora fueron saqueadas (Garcés et al. 2020). Sin embargo, según los resultados de este trabajo y lo visto en campo, la presencia de saqueadores no fue tan alta como lo reportado por Garcés et al. (2020), hecho que puede estar directamente relacionado con la baja cantidad de tortugas presentes durante la época en examen. Es plausible que esta amenaza no sea igual de significativa durante la temporada de tortuga verde.
De acuerdo con lo encontrado durante el estudio, las tortugas verdes presentan una clara preferencia al elegir el sitio de anidación. Se identificó que la selección depende de los siguientes factores: el área disponible, la presencia de vegetación y el avance de la erosión. Es evidente la tendencia de esta especie por anidar en la zona alta de la playa, bajo la cobertura vegetal. Este resultado también fue descrito por Garcés et al. (2020) en playa Lagarto, para las hembras de tortuga verde. Asimismo, es un comportamiento asociado a dicha especie en diferentes regiones, tanto de las costas del Pacífico como del Caribe (Azanza-Ricardo, 2009; Zavaleta-Lizárraga& Morales-Mávil, 2013; Santindrián et al. 2015).
La estrategia puede incrementar la supervivencia de las nidadas que se encuentran situadas en áreas con vegetación, ya esta última se vincula con una mayor lejanía a la línea de marea alta (Mortimer, 1990), lo cual también mitiga los efectos de la erosión (Fish et al. 2005; Santidrián-Tomillo et al. 2015). Además, puede proporcionar condiciones de desarrollo óptimas para los embriones, al estar a la sombra de la vegetación, aspecto que induce a temperaturas de incubación más bajas, lo que a su vez tiene una relación directa con el desarrollo predominante de machos (Kamel, 2013).
De igual forma, se evidenció cómo el proceso de erosión de la playa afecta negativamente el éxito de anidación, puesto que la formación de bermas impide el acceso a las zonas altas playeras, una amenaza descrita previamente para las tortugas marinas (Bolongaro-Crevenna et al. 2010). Por otra parte, el éxito de anidación también se vio alterado durante el mes de marzo, debido a un aumento en las actividades catalogadas como “no puso”, lo que indica que la tortuga inició una o varias cámaras de anidación inconclusas que se veían constantemente colapsadas. Esto puede deberse a que, al estar más adentrados en la época seca, la arena era notablemente más seca y disuelta, lo cual dificultó el proceso de formación de la cámara para las tortugas. Tal problemática se explicó antes en la isla Ascensión, donde la arena es principalmente seca y gruesa (Mortimer, 1990).
La categorización de la marea permitió comprender cómo su fluctuación influye en el proceso de anidadas. El resultado obtenido indica que la tortuga verde tiende a anidar en las fases cercanas a la marea alta. Se ha puntualizado que esto disminuye la distancia por recorrer en la playa, con el afán de llegar a la vegetación, lo que le permite aprovechar el efecto facilitador para acceder a la zona alta y evitar quedarse atrapada en las mareas más bajas (Fretey & Girondot, 1989; Chen & Cheng, 1995). De este modo, se facilita el proceso de anidación con un menor gasto energético (Azanza-Ricardo, 2009). A partir del resultado, se recomienda concentrar los monitoreos en las horas cercanas a las mareas altas, para optimizar el esfuerzo de la acción.
Aunque la temporada estudiada presentó un bajo número de hembras anidantes y nidadas, la reanidación de las tortugasPY250, PY252, PY254, PY257 y PY263 podría indicar una fidelidad a la playa de anidación. Además, resulta notable la presencia de hembras jóvenes de tallas pequeñas, lo que indica un posible crecimiento de esta colonia de anidación. Dado que se trata de una especie en peligro de extinción, es indispensable continuar el marcaje de hembras y el estudio del comportamiento de anidación en las siguientes temporadas, en busca de corroborar su importancia respecto a las demás colonias de anidación de tortuga verde de la península de Azuero, y de continuar enfocando los esfuerzos de investigación y conservación para esta especie en playa Lagarto. Finalmente, se recomienda evaluar el éxito de eclosión y de emergencia de las nidadas naturales, con el fin de estimar cuántos neonatos está produciendo la playa.
A Tortugas Pedasí, la organización responsable del proyecto y cuyas personas responsables llevan más de 10 años protegiendo a las tortugas marinas de esta playa. También, agradecemos a los evaluadores de la Revista Ciencias Marinas y Costeras, por su tiempo y esfuerzo.
Alvarado-Díaz, J., Delgado-Trejo, C. & Suazo-Ortuño, I. (2001). Evaluation of black turtle project in Michoacán, México. Mar. Turt. Newsl., 92, 4-7.
Araúz, E., Pacheco, L., Binder, S., Ycaza, R. & Posada, J. (Eds.) (2017). Plan de Acción Nacional para la Conservación de las Tortugas Marinas en Panamá. Panamá. Sin editorial.
Azanza-Ricardo, J. (2009). Estrategia reproductiva de la tortuga verde, Chelonia mydas, (Testudines, Cheloniidae) y su impacto en la estructura genética de áreas de anidación del occidente del archipiélago cubano. (Tesis de doctorado no publicada). Universidad de La Habana, Cuba.
Blanco, G. S., Morreale, S. J., Bailey, H., Seminoff, J. A., Paladino, F. V. & Spotila, J. R. (2012). Post-nesting movements and feeding grounds of a resident East Pacific green turtle Chelonia mydas population from Costa Rica. Endanger. Species Res., 18(3), 233-245. https://doi.org/10.3354/esr00451
Bolongaro-Crevenna, A., Márquez-García, A. Z., Torres-Rodríguez, V. & García-Vicario, A. (2010). Vulnerabilidad de sitios de anidación de tortugas marinas por efectos de erosión costera en el estado de Campeche. En A.V. Botello, S. Villanueva-Fragoso, J. Gutiérrez & J. L. Rojas-Galaviz (Eds.), Vulnerabilidad de las zonas costeras mexicanas ante el cambio climático (pp. 73-96). México: Universidad Autónoma de Campeche.
Broderick, A. C., Glen, F., Godley, B. J. & Hays, G. C. (2003). Variation in reproductive output of marine turtles. J. Exp. Mar. Biol. Ecol., 288(1), 95-109. https://doi.org/10.1016/S0022-0981(03)00003-0
Camacho-Sánchez, F. Y., Aguirre, A. A., Narváez-Zapata, J. A., Zavala-Norzagaray, A. A., Ley-Quiñónez, C. P., Acosta-Sánchez, H. H., Rodríguez-González, H., Delgado-Trejo, C. & Reyes-López, M. A. (2021). DNA barcode analysis of the endangered green turtle (Chelonia mydas) in Mexico. Genome, 64(9), 879-891. https://doi.org/10.1139/gen-2019-0213
Castillero, R. G., López-Lozano, L. F. & Jiménez-Arias, S. (2024). Caracterización de la actividad de anidación de tortugas marinas en playa Morrillo, Veraguas, Panamá. Tecnociencia, 26(1), 39-59. https://doi.org/10.48204/j.tecno.v26n1.a4649
Chacón-Chaverri, D., Martínez-Cascante, D. A., Rojas, D. & Fonseca, L. G. (2015). Captura por unidad de esfuerzo y estructura poblacional de la tortuga verde de Pacífico (Chelonia mydas) en el Golfo Dulce, Costa Rica. Rev. Biol. Trop., 63, 363-373. http://dx.doi.org/10.15517/rbt.v63i1.23115
Chassin-Noria, O. & Abreu-Grobois, F. A. (2002). Estructura genética y sistemática molecular de la tortuga negra Chelonia mydas (Linnaeus, 1758) del estado de Michoacán, México. (Tesis de maestríano publicada). Universidad Nacional Autónoma de México, México.
Chen, T. H. & Cheng, I. J. (1995). Breeding biology of the green turtle, Chelonia mydas (Reptilia: Cheloniidae), on WanAn Island, PengHu archipelago, Taiwan. Nesting ecology. Mar. Biol., 124, 9-15. https://doi.org/10.1007/BF00349141
CIT (Convención Interamericana para la Protección y Conservación de las Tortugas Marinas). (2020). Informe Anual 2019-2020. Panamá. Sin Editorial.
Cutzi, B. O., Miguel-Ángel, R. L., Hervey, R. G. & Carlos, D. T. (2023). Black Sea Turtle (Chelonia mydas agassizii) Life History in the Sanctuary of Colola Beach, Michoacan, Mexico. Animals, 13(3), 406.https://doi.org/10.3390/ani13030406
Eckert, K. L., Bjorndal, K. A., Abreu-Grobois, F. A. & Donnelly, M. (Eds.) (2000). Técnicas de Investigación y Manejo para la Conservación de las Tortugas Marinas. EE. UU. Grupo Especialista en Tortugas Marinas UICN/CSE. Sin Editorial.
Fish, M. R., Côté, I. M., Gill, J. A., Jones, A. P., Renshoff, S. & Watkinson, A. R. (2005). Predicting the impact of sea-level rise on Caribbean Sea turtle nesting habitat. Conserv. Biol., 19(2), 482-491. https://doi.org/10.1111/j.1523-1739.2005.00146.x
Flores, E., De La Cruz, J., Seminoff, J. & Ureña, L. (2021). Local ecological knowledge supports identification of sea turtle nesting beaches in Panama. Herpetol. Conserv. Biol.,16(2), 238-250.
Fonseca, L. G., Santidrián-Tomillo, P., Villachica, W. N., Quirós, W. M., Pesquero, M., Heidemeyer, M., Joyce, F., … &Valverde, R. A. (2018). Discovery of a major East Pacific green turtle (Chelonia mydas) nesting population in Northwest Costa Rica. Chelonian Conserv. Biol., 17(2), 169-176. https://doi.org/10.2744/CCB-1264.1
Fretey, J. & Girondot, M. (1989). Hydrodynamic factors involved in choice of nesting site and time of arrivals of leatherbacks in French Guiana. In S. A. Eckert, K. L. Eckert & T. H. Richardson (comps.), Proceedings of the Ninth Annual Workshop on Sea Turtle Conservation and Biology (pp. 227-229). EE. UU.: NOAA TechnicalMemorandum.
Gagné-Landmann, S. E. (2017). Challenges relating to development projects in the Pablo Arturo Barrios Wildlife refuge. Canadá. Sin editorial.
Garcés, H., Batista, A. & Sánchez, N. (2020). Caracterización de sitios de anidación de tortugas marinas en playa Lagarto, Pedasí, provincia de Los Santos, Panamá. Tecnociencia 22(2), 259-277. https://doi.org/10.48204/j.tecno.v22n2a14
González, A. (2013). Caracterización física y biológica de la playa de anidación de tortugas marinas de Mata Oscura, Veraguas, Panamá. (Tesis de licenciatura no publicada). Universidad Marítima Internacional de Panamá, Panamá.
Groombridge, B. & Wright, L. (comps.). (1982). The IUCN Amphibia-Reptilia Red Data Book. Part 1: Testudines, Crocodylia, Rhynchocephalia. United Kingdom. UICN.
Hart, C. E., Blanco, G. S., Coyne, M. S., Delgado-Trejo, C., Godley, B. J., Jones, T. T., … & Nichols, W. J. (2015). Multinational tagging efforts illustrate regional scale of distribution and threats for East Pacific green turtles (Chelonia mydas agassizii). PLoSOne, 10(2), e0116225. https://doi.org/10.1371/journal.pone.0116225
Heidemeyer, M., Arauz-Vargas, R. & López-Agüero, E. (2014). New foraging grounds for hawksbill (Eretmochelys imbricata) and green turtles (Chelonia mydas) along the northern Pacific coast of Costa Rica, Central America. Rev. Biol. Trop., 62(4), 109-118.https://doi.org/10.15517/rbt.v62i4.20037
Holroyd, G. L. & Trefry, H. E. (2010). The importance of Isla Clarion, Archipelago Revillagigedo, Mexico, for green turtle (Chelonia mydas) nesting. Chelonian Conserv. Biol., 9(2), 305-309. https://doi.org/10.2744/CCB-0831.1
Kamel, S. J. (2013). Vegetation cover predicts temperature in nests of the hawksbill sea turtle: implications for beach management and offspring sex ratios. Endanger. Species Res., 20(1), 41-48. https://doi.org/10.3354/esr00489
Kamezaki, N. & Matsui, M. (1995). Geographic variation in skull morphology of the green turtle, Chelonia mydas, with a taxonomic discussion. J. Herpetol., 51-60. https://doi.org/10.2307/1565085
Lombardo, R. C. & Saavedra, D. Y. (2023). Características de la anidación de tortugas marinas: Lepidochelys olivacea y Chelonia mydas, en playa Lagarto, Los Santos, Panamá. Tecnociencia, 25(1), 63-88.
Márquez, R. M. (1990). Sea turtles of the world. An annotated and illustrated catalogue of sea turtles species known to date. FAO Fish, 125(11), 1-81.
Miller, J. D. (1997). Reproduction in sea turtles. In P. L. Lutz & J. A. Musick (Eds.), The Biology of Sea Turtles (pp. 51-83). EE. UU.: CRC Press.
Ministerio de Ambiente de Panamá. (2017). Informe del estado parte sobre el sitio de Patrimonio Mundial Parque Nacional Coiba y su Zona Especial de Protección Marítima. Panamá. Sin editorial.
Ministerio del Ambiente del Ecuador. (2014). Plan Nacional para la Conservación de las Tortugas Marinas. Ecuador. Sin editorial.
Mortimer, J. A. (1990). The influence of beach sand characteristics on the nesting behavior and clutch survival of green turtles (Chelonia mydas). Copeia, 1990(3), 802-817. https://doi.org/10.2307/1446446
Naro-Maciel, E., Le, M., FitzSimmons, N. N. & Amato, G. (2008). Evolutionary relationships of marine turtles: a molecular phylogeny based on nuclear and mitochondrial genes. Mol. Phylogenet. Evol., 49(2), 659-662. https://doi.org/10.1016/j.ympev.2008.08.004
Pritchard, P. C. H. & Mortimer, J. A. (1999). Taxonomy, external morphology, and species identification. Res. Manage. Tech. Conserv. Sea Turt., 21, 11-13.
Rodríguez, B. & Contreras, M. (2020). Conservación de tortugas Lora (Lepidochelys olivacea), en playa Mata Oscura, Veraguas, pacífico de Panamá. Revista Saberes APUDEP, 3(2), 82-91. https://doi.org/10.48204/j.saberes.v3n2a7
RStudioTeam. (2020). RStudio: Integrated Development for R. RStudio, PBC, EE. UU. http://www.rstudio.com
Santidrián-Tomillo, P., Roberts, S. A., Hernández, R., Spotila, J. R. & Paladino. F. V. (2015). Nesting ecology of East Pacific green turtles at Playa Cabuyal, Gulf of Papagayo, Costa Rica. Mar. Ecol., 36(3), 506-516. https://doi.org/10.1111/maec.12159
Seminoff, J. A. (2004). Chelonia mydas. The IUCN Red List of Threatened Species. Southwest Fisheries Science Center, EE. UU. https://dx.doi.org/10.2305/IUCN.UK.2004.RLTS.T4615A11037468.en
Seminoff, J. A., Allen, C. D., Balazs, G. H., Dutton, P. H., Eguchi, T., Haas, H. L., … & Waples, R. S. (2015). Status Review of the Green Turtle (Chelonia mydas) Under the Endangered Species Act. EE. UU. NOAA Technical Memorandum.
Wallace, B. P., Kot, C. Y., DiMatteo, A. D., Lee, T., Crowder, L. B. & Lewison, R. L. (2013). Impacts of fisheries bycatch on marine turtle populations worldwide: toward conservation and research priorities. Ecosphere, 4(3), 1-49. https://doi.org/10.1890/ES12-00388.1
Zavaleta-Lizárraga, L. & Morales-Mávil, J. E. (2013). Nest site selection by the green turtle (Chelonia mydas) in a beach of the north of Veracruz, Mexico. Rev. Mex. Biodiv., 84(3), 927-937. https://doi.org/10.7550/rmb.31913
1 Organización Tortugas Pedasí, Panamá. luisa.lopez3110@gmail.com ORCID: https://orcid.org/0009-0003-59040330; santiago.jimenez.arias1@gmail.com ORCID: https://orcid.org/0009-0004-0813-5812




