Rev. Mar. Cost. ISSN 1659-455X. Vol. 3: 31-41, Diciembre 2011.
DOI: https://doi.org/10.15359/revmar.3.2
PRODUCTIVIDAD PRIMARIA EN LAGUNA LARGA,
CAYO COCO, CUBA
PRIMARY PRODUCTIVITY IN LAGUNA LARGA,
CAYO COCO, CUBA
Mayrene Guimarais Bermejo1* y Roberto González de Zayas1
1 Centro de Investigaciones de Ecosistemas Costeros (CIEC), Cayo Coco. Ciego de Ávila. C.P. 69400. Cuba.
mayrene@ciec.fica.inf.cu
Recibido 19-VII-2010
Aceptado 17-VIII-2011
RESUMEN
Se determinó la productividad primaria en Laguna Larga, ubicada en la costa norte y central de Cayo Coco. La producción primaria del fitoplancton y la biomasa del macrofitobentos fueron medidas durante el 2008-2009 en dos sectores de la laguna. La producción primaria neta acuática del sector este fue de 4.32 ± 3.59 g C m-2 día-1 y en el sector oeste fue de 0.71 ± 0.41 g C m-2 día-1. Ambos sectores, atendiendo a la relación producción/respiración anual, fueron autotróficos para el oxígeno e hipertróficos para el carbono. Entre las especies más productivas del macrofitobentos estuvieron: Cladophoropsis sp., Halodule wrightii, Cladophora sp. y Ruppia maritima. La alta producción neta acuática registrada en el sector este, con respecto al oeste, se debe a la contribución del macrofitobentos a la productividad total. El fitoplancton en el sector este exhibió baja productividad (0.12 ± 0.07 g C m-2 día-1) con respecto al oeste (0.71 ± 0.41 g C m-2 día-1), lo que puede deberse a la competencia del macrofitobentos por los nutrientes.
Palabras claves: Fitoplancton, macrofitobentos, producción primaria neta, estado trófico.
ABSTRACT
Phytoplankton primary productivity and macrophyte biomass were determined during 2008-2009 for Laguna Larga, located on the north-central coast of Cayo Coco, Cuba. Aquatic net primary production was measured in two different sectors of the lagoon resulting in 4.32 ± 3.59 g C m-2 d-1 and 0.71 ± 0.41 g C m-2 d-1 in the eastern and western part, respectively. In regard to the annual production to respiration ratio, both sections showed autotrophic and hypertrophic levels for the oxygen and carbon metabolisms. The most productive species were Cladophoropsis sp., Halodule wrightii, Cladophora sp., and Ruppia maritima. Aquatic net production recorded for the eastern lobe was higher than the western lobe because of the macrophytobenthos contribution to total productivity. On the contrary, phytoplankton productivity in the eastern part was lower (0.12 ± 0.07 g C m-2 d-1) than the western lobe (0.71 ± 0.41 g C m-2 d-1), probably due to the macrophyte competition for nutrients.
Keywords: Phytoplankton, macrophytobenthos, aquatic net primary production, trophic level.
INTRODUCCIÓN
La calidad de las aguas costeras en muchas regiones del mundo se ha deteriorado en años recientes como consecuencia del incremento de las actividades humanas (Newton et al. 2003). Las lagunas costeras son particularmente vulnerables a la eutrofización, debido al intercambio restringido con el océano adyacente, haciendo que acumulen nutrientes suministrados por vertimientos de aguas circundantes (Caumette et al. 1996; Taylor et al. 1999).
Con el progresivo incremento de las entradas de nutrientes (Howarth et al. 1996) y las cada vez mayores eutrofizaciones en estuarios (Howarth y Marino, 2006; Pinckney et al. 2001; Smith, 2006) y otras aguas costeras (Berman et al. 2005; Rabalais et al. 2002), se ha generalizado el interés por conocer el rol de la producción primaria en ecosistemas acuáticos.
El estado trófico es una propiedad fundamental íntimamente relacionada tanto con la estructura del ecosistema como con la influencia de los seres humanos en la calidad del agua. Los estados autotrófico y heterotrófico están definidos por las tasas de fotosíntesis y respiración que involucran los flujos de carbono y ambos son usados para caracterizar los ecosistemas. En sistemas acuáticos donde la luz llega al fondo, la producción béntica y planctónica puede ser importante para definir estos estados tróficos (Dodds y Cole, 2007).
La importancia de la producción primaria béntica ha sido ampliamente subestimada en lagunas y sistemas marinos costeros (Santos et al. 2004; Vadeboncoeur et al. 2006; Wetzel, 2001) y podría ser la causa de los valores publicados alrededor de cero en las producciones netas de muchas lagunas y lagos a escala global (Andersson y Brunberg, 2006).
El objetivo de este trabajo fue determinar en una laguna costera de Cayo Coco, Cuba, la producción primaria de sus principales comunidades vegetales acuáticas (fitoplancton y macrofitobentos), con el propósito de diagnosticar su estado trófico, teniendo en cuenta que esta se encuentra sometida a acciones antrópicas que afectan la calidad del agua. Se identificaron, además, las especies más productivas del macrofitobentos en el metabolismo del oxígeno.
MATERIALES Y MÉTODOS
Área de estudio
El trabajo se realizó en Laguna Larga, localizada en la costa norte y central de Cayo Coco, perteneciente al Archipiélago Sabana-Camagüey, Cuba (Fig. 1), la cual presenta una configuración alargada y estrecha con un área total de 0.22 km2. Esta laguna se encuentra subdividida en tres sectores o partes que se conectan entre sí por estrechos canales. La parte este posee un canal de mareas que permite el intercambio directo con el mar adyacente; mientras que la conexión con los sectores más occidentales es mucho más limitada, llegando a ser nula durante mareas muertas y períodos poco lluviosos. Laguna Larga tiene la particularidad de poseer sobre sus aguas y alrededores instalaciones hoteleras, que en gran medida han influido sobre las limitaciones de intercambio de agua existentes, entre sus partes o sectores.

Los muestreos se llevaron a cabo en dos de sus sectores: este y oeste, teniendo en cuenta, fundamentalmente, el desarrollo del macrofitobentos y del fitoplancton. En el sector este existe representación de ambas comunidades, por su parte, al oeste de la laguna solo hay desarrollo fitoplanctónico. Lo antepuesto, unido al intercambio limitado entre ambas partes, llevó a contemplarlas en el estudio como sistemas acuáticos diferentes: sector este con intercambio abierto con el mar adyacente y sector oeste con intercambio restringido o estacional.
Muestreo de campo y procesamiento de datos
El período de estudio abarcó dos épocas climáticamente diferentes en Cuba: poco lluviosa y lluviosa (Lecha et al. 1994), realizándose dos muestreos por época. El fitoplancton se muestreó en abril, julio y octubre del 2008 y febrero del 2009, mientras que el macrofitobentos se muestreó en abril, julio, octubre y diciembre del 2008.
La producción del fitoplancton fue determinada según el método de botellas claras y oscuras incubadas in situ (Vollenweider, 1974; Wetzel y Likens, 1991). Se ubicaron cuatro estaciones de muestreo, dos fueron localizadas en el sector oeste, Blau 1 (22° 32’ 51; 78° 22’ 40) y Blau 2 (22° 32’ 37; 78° 22’ 25) y dos en el sector este de la laguna, NHKrystal 1 (22° 32’ 22; 78° 21’ 52) y NHKrystal 2 (22° 32’ 09; 78° 21’ 41), las que fueron situadas teniendo en cuenta la transparencia del agua como indicadora de la abundancia fitoplanctónica.
En cada estación se tomaron tres muestras iniciales de oxígeno disuelto, y se incubaron, en un intervalo de 4-6 horas, tres botellas claras y tres botellas oscuras con capacidad de 120 ml cada una (Wetzel y Likens, 1991). Para las incubaciones bajo luz se utilizaron botellas de vidrio translúcido, mientras que las botellas para la incubación oscura fueron totalmente aisladas de la luz.
El oxígeno disuelto fue fijado in situ mediante la adición de sulfato de manganeso y yoduro alcalino y de cada botella se hicieron tres réplicas en el laboratorio para la valoración con tiosulfato de sodio (Wright, 1983).
El cálculo de las tasas de producción primaria neta (PPN), producción bruta (PPB) y respiración (R), fueron determinadas de acuerdo con el método propuesto por Wetzel y Likens (1991):
Respiración = Oi - (-O0)
Producción neta = Oc - (-Oi)
Producción bruta = [Oc - (-Oi)] +
[Oi - (-O0)] = Oc -O0
Donde: Oi: concentración de oxígeno inicial.
O0: concentración de oxígeno tras la incubación oscura.
Oc: concentración de oxígeno tras la incubación clara.
Por convención y para sugerir consumo de oxígeno se utilizó el signo negativo en los valores de respiración, es decir, el cálculo fue: Respiración = O0 -Oi .
Para estimar la producción primaria del macrofitobentos, conformado por algas y fanerógamas, primero se determinó la biomasa de las macrófitas presentes en el sector este de la laguna. Para ello se utilizó un nucleador de 15 cm de diámetro (4 réplicas) (CARICOMP, 1994, 2001) y se muestreó en cada parche en que existió cambio en la composición de fanerógamas. Las muestras fueron lavadas con agua de mar para eliminar el sedimento, fijadas con formaldehído al 4% previamente neutralizado con tetraborato de sodio y envasadas en bolsas de plástico y etiquetadas. En el laboratorio, el material fue enjuagado con agua corriente y secado en la estufa a 90°C, hasta alcanzar peso constante. Para el peso se utilizó una balanza digital con una precisión de 0.1 g. El perifiton no se tuvo en cuenta debido a su nulo desarrollo.
Las tasas metabólicas (fotosíntesis y respiración en mg O2 g-1 h-1), para cada género recolectado, se obtuvieron a partir del estudio realizado por Buesa (1975) para algas y fanerógamas cubanas. Estas tasas metabólicas se multiplicaron por las biomasas específicas (g m-2) para cuantificar el metabolismo vegetal medio por unidad de superficie de la zona. De esta manera se obtuvieron la PPB, la R y la PPN (diferencia entre la PPB y la R) para cada especie del macrofitobentos en g O2 m-2 h-1.
Las tasas respiratorias y de fotosíntesis por hora fueron llevadas a tasas de producción diaria, multiplicando por 24 horas para la respiración, y para el caso de la fotosíntesis se multiplicó por 12.3 horas, que es el período medio de insolación que recibe Cuba y por 0.6, que es el factor integral que cuantifica al área bajo la curva de fotosíntesis diaria, dichos datos fueron obtenidos de Buesa (1975). Estos valores fueron usados también para cuantificar la producción diaria del fitoplancton, ya que a pesar de ser grupos tan apartados sistemáticamente entre sí, su actividad fotosintética responde durante el día a la intensidad luminosa y esa variación está regida por la altura aparente del sol (Buesa, 1975).
Los valores metabólicos de oxígeno fueron convertidos a gramos de carbono mediante el factor 0.375, dado por Vollenweider (1974). El orden de productividad por grupos vegetales y especies se determinó por medio del cociente P/R, con los valores medios anuales. De la misma manera, se determinó la productividad del sistema acuático en su conjunto. El análisis de la variación espacio-temporal de la productividad en g O2 m-2 día-1 por grupo vegetal se realizó por medio del CV (%) de la PPN.
RESULTADOS
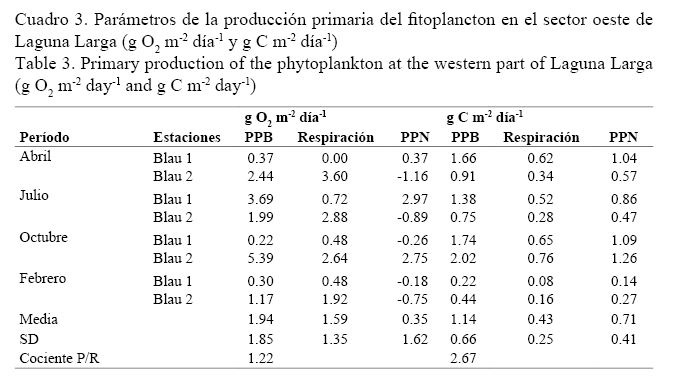
La PPN del fitoplancton en el sector este fue de 0.12 ± 0.07 g C m-2 día-1 y de 0.71 ± 0.41 g C m-2 día-1 en el sector oeste, mientras que la del macrofitobentos fue de 4.20 ± 3.70 g C m-2 día-1. La PPN total del sistema acuático en el sector este fue de 10.68 ± 9.80 g O2 m-2 día-1 y de 4.32 ± 3.59 g C m-2 día-1. En el sector oeste arrojó valores de PPN de 0.35 ± 1.61 g O2 m-2 día-1 y 0.71 ± 0.41 g C m-2 día-1 (Cuadros 1-3).


En el metabolismo del oxígeno, el cociente P/R del macrofitobentos fue mayor que el del fitoplancton en el sector este (Cuadros 1, 2). En este mismo sector, el fitoplancton mostró un comportamiento heterotrófico, esto significa que los procesos de consumo son mayores que los productivos (P/R < 1) y, por el contrario, el macrofitobentos fue autotrófico (P/R > 1). El mayor contribuidor a la producción primaria fue el macrofitobentos y dentro de este grupo vegetal, las especies más productivas, en orden descendente, fueron: Cladophoropsis sp., H. wrightii, Cladophora sp. y R. maritima (Cuadro 4).

El cociente P/R para el sistema acuático en su conjunto (fitoplancton + macrofitobentos) en el sector este de Laguna Larga fue de 1.77, o sea, posee un comportamiento autotrófico para el balance del oxígeno. Este mismo cociente pero para el carbono fue de 1.89. Por otro lado, el fitoplancton en el sector oeste reflejó un comportamiento autotrófico en el balance de oxígeno y un valor de P/R para el carbono de 2.67 (Cuadro 3).
El análisis de la variación espacio-temporal del fitoplancton, en el sector este, reflejó espacialmente una pequeña variación alrededor de la media anual (-0.52 ± 0.14, [CV] 27%), no siendo así temporalmente, donde tuvo un CV del 132% (Cuadro 5). Por su parte, el macrofitobentos mostró una variación temporal ligeramente alta alrededor de la media anual (47.61 ± 27.37, [CV] 57%) (Cuadro 6). En la parte oeste, la variación del fitoplancton resultó alta tanto espacial como temporalmente (Cuadro 7).



DISCUSIÓN
Los valores de producción primaria neta del fitoplancton fueron bajos comparados con los del macrofitobentos y coinciden en gran medida con los ofrecidos por otros autores para zonas similares (Baird y Ulanowicz, 1993; Dame et al. 1986; González-Sansón y Berdayes, 1981; Lignell et al. 1993; Nixon y Pilson, 1984; Randall y Day, 1987). Esta baja producción podría estar relacionada con la competencia que ofrecen los vegetales bentónicos al fitoplancton por los nutrientes, aspecto también abordado en otros trabajos (González-Sansón y Berdayes, 1981 y Margalef, 1969).
Lo anterior resulta muy comprensible, si se tienen en cuenta el aumento de la producción primaria del fitoplancton en el sector oeste, y la ausencia de vegetación en el bentos. Además, puede estar favorecido por una mayor retención de nutrientes, debido al poco intercambio de sus aguas en este sector (Contreras et al. 2005; Flores-Verdugo et al. 1988). Esto explica también el hecho de que en el sector este el fitoplancton haya tenido un comportamiento heterotrófico y en el sector oeste autotrófico, en el balance del oxígeno.
La producción neta del macrofitobentos (angiospermas y macroalgas), en términos generales, fue mucho mayor que la del fitoplancton y coincide con un estudio compilativo realizado por Cebrian (2002). El orden de productividad de las especies del bentos encontradas en este estudio coincide con lo informado por Buesa (1975), donde la angiosperma H. wrightii resultó la más productiva de Cuba.
El estado trófico, en ambos sectores, según el coeficiente P/R para el carbono fue hipertrófico (Likens et al. 1977). Teniendo en cuenta el enriquecimiento de nutrientes a que está sometida la laguna, se vuelve entonces muy importante el hecho de que ambos sectores sean autotróficos en el metabolismo del oxígeno, ya que significa que los productores (macrofitobentos y fitoplancton) suministran el oxígeno necesario para la oxidación de la materia orgánica producida y, por lo tanto, mantienen el equilibrio del sistema acuático.
La variación espacial y temporal del fitoplancton, en ambos sectores, puede deberse a varios factores:
i) la variación espacial en las estaciones situadas (1 y 2) tienen diferentes condiciones en cuanto a profundidad (influye en la evolución diaria de la temperatura), viento y nutrientes, determinando la distribución del fitoplancton en parches, por lo que las tasas medidas dependen de las características de cada sitio.
ii) desde el punto de vista temporal, según González de Zayas (inédito), existen diferencias significativas en el ciclo anual de varios parámetros fisicoquímicos como: temperatura, salinidad, amonio, silicatos, Nt y Pt. La heterogeneidad en el comportamiento de estos parámetros influye en la concentración, distribución y metabolismo de la masa fitoplanctónica en la laguna.
iii) no se tiene evidencia de otros factores, pero entre estos se pueden señalar la abundancia y distribución del zooplancton, así como el flujo de aguas alóctonas que son vertidas en Laguna Larga, y las condiciones climáticas, como intensidad de la luz y vientos predominantes.
La variación temporal del macrofitobentos puede ser explicada a partir de la eliminación antrópica de la angiosperma sumergida R. maritima en octubre del 2008. Entre las especies vegetales más productivas se encuentra esta angiosperma, lo que significa que es una de las mayores contribuidoras a las adecuadas condiciones de oxigenación de la laguna, lo cual tiene mayor importancia si se tienen en cuenta las características hipertróficas del sector. Los resultados obtenidos en este trabajo tienen grandes implicaciones para el manejo de la laguna, por lo que sería de gran importancia su divulgación, con el fin de que no sucedan acciones antrópicas que podrían desestabilizar el sistema acuático, con alcances a ecosistemas adyacentes como: manglares, playas, pastos marinos y arrecifes coralinos.
BIBLIOGRAFÍA
Andersson, E. & Brunberg, A-K. (2006). Net autotrophy in an oligotrophic lake rich in dissolved organic carbon and with high benthic primary production. Aquat. Microb. Ecol., 43, 1-10.
Baird, D. & Ulanowicz, R. E. (1993). Comparative study on the trophic structure, cycling and ecosystem properties of four tidal estuaries. Mar. Ecol. Prog. Ser., 99, 221-237.
Beman, J. M., Arrigo, K. R. & Matson, P. A. (2005). Agricultural runoff fuels large phytoplankton blooms in vulnerable areas of the ocean. Nature, 434, 211-214.
Buesa, R. J. (1975). Fotosíntesis y respiración de plantas marinas. INP/CIP, Cuba. Res. Invest., (1), 45-50.
CARICOMP. (1994). CARICOMP Methods Manual-Level I. Manual of Methods for Mapping and Monitoring of Physical and Biological Parameters in the Coastal Zone of the Caribbean. University of the West Indies, Mona, Kingston, Jamaica: CARICOMP Data Management Center.
CARICOMP. (2001). CARICOMP Methods Manual. Levels I & II. Methods for Mapping and Monitoring of Physical and Biological Parameters in the Coastal Zone of the Caribbean. Kingston, Jamaica y Florida, EE.UU.: CARICOMP Data Management Center.
Caumette, P., Castel, J. & Herbert, R. (eds.) (1996). Coastal Lagoon Eutrophication and Anaerobic Processes (CLEAN) Nitrogen and Sulfur Cycles and Population Dynamics in Coastal Lagoons Developments in Hydrobiology, 117. Dordrecht, Netherlands: Kluwer Academic Publishers, Dordrecht.
Cebrian, J. (2002). Variability and control of carbon consumption, export, and accumulation in marine communities. Limnol. Oceanogr., 47(1), 11-22.
Contreras-Espinosa, F., Rivera-Guzmán, N. & Segura-Aguilar, R. (2005). Nutrientes y productividad primaria fitoplanctónica en una laguna costera tropical intermitente (La Marcha, Ver.) del Golfo de México. Hidrobiológica, 15(3), 299-310.
Dame, R., Chrzanowski, T., Bildstein, K., Kjerfve, B., McKellar, H., Nelson, D., Spurrier, J., Stancyk, S., Stevenson, H., Vernberg, J. & Zingmark, R. (1986). The outwelling hypothesis and North Inlet, South Carolina. Mar. Ecol. Prog. Ser., 33, 217-229.
Dodds, W. & Col, J. J. (2007). Expanding the concept of trophic state in aquatic ecosystems: It’s not just the autotrophs. Aquat. Sci., 69, 427-439.
Flores-Verdugo, F. J., Day, J., Mee, L. & Briseño-Dueñas, R. (1988). Phytoplankton Production and Seasonal Biomass Variation of Seagrass, Ruppia maritima L., in a Tropical Mexican Lagoon with an Ephemeral Inlet. Estuaries, 11(1), 51-56.
González-Sansón, G. & Berdayes, J. (1981). La producción primaria en las lagunas costeras de Tunas de Zaza, Cuba. Rev. Invest. Mar., 2, 109-139.
Howarth, R. W. & Marino, R. (2006). Nitrogen as the limiting nutrient for eutrophication in coastal marine ecosystems: Evolving views over three decades. Limnol. Oceanogr., 51(1, part 2), 364-376.
Howarth, R. W., Billen, G., Swaney, D., Townsend, A., Jaworski, N., Lajtha, K., Downing, J. A., Elmgren, R., Caraco, N., Jordan, T., Berendse, F., Freney, J., Kudeyarov, V., Murdoch, P. & Zhao-Liang, Z. (1996). Regional nitrogen budgets and riverine N & P fluxes for the drainages to the North Atlantic Ocean: Natural and human influences. Biogeochemistry, 35, 75-139.
Lecha, L., Paz, L. & Lapinel, B. (1994). El clima de Cuba. La Habana, Cuba: Ed. Academia.
Lignell, R., Heiskanen, A. S., Kuosa, H., Gundersen, K., Kuuppo-Leinikki, P., Pajuniemi, R. & Uitto, A. (1993). Fate of phytoplankton spring bloom: sedimentation and carbon flow in the planktonic food web in the northern Baltic. Mar. Ecol. Prog. Ser., 94, 239-252.
Likens, G. E., Bormann, F. H., Pierce, R. S., Eaton, J. S. & Jhonson, N. M. (1977). Biogeochemistry of a forested ecosystem. New York, EE.UU.: Springer Verlag.
Margalef, R. (1969). Comunidades planctónicas en lagunas litorales. En A. Ayala & F. B. Phleger (Eds.), Memorias de Simposio Internacional Lagunas Costeras, México (pp. 545-562). México D.F.: UNAM (Universidad Nacional Autónoma de México). UNESCO.
Newton, A., Icely, J. D., Falcão, M., Nobre, A., Nunes, J. P., Ferreira, J. G. & Vale, C. (2003). Evaluation of eutrophication in the Ria Formosa coastal lagoon, Portugal. Cont. Shelf Res., 23, 1945-1961.
Nixon, S. & Pilson, M. E. (1984). Estuarine total system metabolism and organic exchange calculated from nutrient ratios: an example from Narragansset Bay. En V. S. Kennedy (Ed.), The Estuary as a filter (pp. 261-291). New York, EE.UU.: Academic Press.
Pinckney, J. L., Paerl, H. W., Tester, P. & Richardson, T. L. (2001). The role of nutrient loading and eutrophication in estuarine ecology. Environ. Health Perspect., 109 (Supplement 5), 669-706.
Rabalais, N. N., Turner, R. E. & Wiseman, W. J. (2002). Gulf of Mexico hypoxia, AKA “The dead zone.” AnnU. Rev. Ecol. Syst., 33, 235-263.
Randall, J. & Day, J. W. (1987). Effects of river discharge and vertical circulation on aquatic primary production in a turbid Lousiana (USA). Neth. J. Sea Res., 21, 231-242.
Santos, R., Silva, J., Alexandre, A., Navarro, N., Barrón, C. & Duarte, C. M. (2004). Ecosystem Metabolism and Carbon Fluxes of a Tidally-Dominated Coastal Lagoon. Estuaries, 27(6), 977-985.
Smith, V. H. (2006). Responses of estuarine and coastal marine phytoplankton to nitrogen and phosphorus enrichment. Limnol. Oceanogr., 51, 377-384.
Taylor, D. I., Nixon, S. W., Granger, S. L. & Buckley, B. A. (1999). Responses of Coastal Lagoon Plant Communities to Levels of Nutrient Enrichment: A Mesocosm Study. Estuaries, 22(4), 1041-1056.
Vadeboncoeur, Y., Kalff, J., Christoffersen, K. & Jeppesen, E. (2006). Substratum as a driver of variation in periphyton chlorophyll and productivity in lakes. J. N. Am. Benthol. Soc., 25, 379-392.
Vollenweider, R. A. (1974). A Manual of Methods for Measuring Primary Production in Aquatic Environments. IBP Handbook No. 12. London, England: Blackwell.
Wetzel, R. G. & Likens, G. E. (1991). Limnological Analyses. 2nd ed. New York: EE.UU.: W. B. Springer-Verlag.
Wetzel, R. G. (2001). Limnology: lake and river ecosystems. 3rd ed. San Diego, EE.UU.: Academic Press.
Wright, R. C. (1983). A Modified Field Version of the Winkler Determination of Dissolved Oxygen for Testing Remote Sources of Water. New Phytologist, 95(1), 37-40.
