
Revista UNICIENCIA
Uniciencia Vol. 38(1), January-December, 2024
E-ISSN: 2215-3470
DOI: https://dx.doi.org/10.15359/ru.38-1.27
Validación de un método de cromatografía líquida (HPLC-UV/Vis) para la cuantificación de aldehídos en agua de lluvia y aire
Validation of a liquid chromatography method (HPLC-UV/Vis) to quantify aldehydes in rainwater and air
Validação de um método de cromatografia líquida (HPLC-UV/Vis) para a quantificação de aldeídos em águas pluviais e atmosféricas
Melissa Araya Araya1, José Pablo Sibaja Brenes1*, Roy Soto Fallas2, José Carlos Mora-Barrantes1,
Rosa Alfaro Solís1, Henry Borbón-Alpízar1, Juan Valdés González1
Received: Aug/17/2023 • Accepted: May/9/2024 • Published: Aug/31/2024
|
Resumen Los aldehídos son compuestos presentes en la atmósfera que se forman por la degradación fotoquímica de otros compuestos orgánicos en la tropósfera, estos pueden ser emitidos por fuentes naturales o antropogénicas. [Objetivo] En el presente trabajo se implementó un método analítico para la cuantificación de muestras de aldehídos en matrices como aire y agua de lluvia. [Metodología] El muestreo y el análisis de los aldehídos utilizó la metodología TO-11 de la Agencia de Protección Ambiental de los Estados Unidos (EPA). El muestreo se realizó mediante el uso de cartuchos de adsorción recubiertos con una disolución de 2,4-DNFH, formando una hidrazona con los aldehídos presentes en el agua de lluvia y en el aire. Estos fueron analizados mediante un cromatógrafo de líquido acoplado a un detector UV-Visible (HPLC-UV/Vis). Para la validación de la técnica de análisis y la calidad analítica de los resultados se determinaron: linealidad, sensibilidad, límites de cuantificación, límites de detección, repetibilidad, reproducibilidad y porcentaje de recuperación. En el caso de la repetibilidad, se utilizó la comparación del coeficiente de variación de Horwitz con los porcentajes de desviación estándar relativo (% DER) de las muestras. [Resultados] Los límites de detección obtenidos oscilan entre 0,18 μg/m3 para el acetaldehído y 3,20 μg/m3 en el caso de la acroleína, mientras que los límites de cuantificación están entre 0,62 μg/m3 para el acetaldehído y 4,70 μg/m3 para el heptanal; datos que garantizan la calidad analítica del método. [Conclusiones] En general, el método de análisis para los aldehídos mostró una buena correlación lineal, con valores de R2 igual o mayores a 0,9991 para cada curva de calibración, y valores de porcentajes de desvío relativo menores al 2,25 %, lo cual indica una buena precisión en el análisis. Palabras clave: aldehídos; agua de lluvia; cromatografía; validación; límites de detección; límites de cuantificación. Abstract Aldehydes are compounds in the atmosphere formed by the photochemical degradation of other organic compounds in the troposphere and can be emitted by natural or anthropogenic sources. [Objective] An analytical method was implemented to quantify aldehyde samples in matrices such as air and rainwater. [Methodology] Aldehyde sampling and analysis were conducted using method TO-11 from the United States Environmental Protection Agency (EPA). Sampling was carried out by using adsorption cartridges coated with a 2,4-DNPH solution, forming a hydrazone with the aldehydes present in the rainwater and the air, which were tested using a liquid chromatograph coupled to a UV-visible detector (HPLC-UV/Vis). To validate the analysis technique and the analytical quality of the results, the following was determined: linearity, sensitivity, quantification limits, detection limits, repeatability, reproducibility, and recovery percentage. In the case of repeatability, the comparison of the Horwitz coefficient of variation was used with the percentages of relative standard deviation (% RSD) of the samples. [Results] The detection and quantification limits obtained range between 0.18 μg/m3 and 3.20 μg/m3 for acetaldehyde and acrolein, respectively, while quantification limits are between 0.62 μg/m3 for acetaldehyde and 4.70 μg/m3 for heptanal, data that characterizes the method’s analytical quality. [Conclusions] In general, the analysis method for aldehydes showed linearity, with R2 values equal to or greater than 0.9991 for each calibration curve, and relative deviation percentage values less than 2.25 %, indicating good precision in the analysis. Keywords: Aldehydes; rainwater; chromatography; validation; detection limits; quantification limits. Resumo Os aldeídos são compostos presentes na atmosfera que são formados pela degradação fotoquímica de outros compostos orgânicos na troposfera, estes podem ser emitidos por fontes naturais ou antrópicas. [Objetivo] No presente trabalho, foi implementado um método analítico para a quantificação de amostras de aldeído em matrizes como ar e água da chuva. [Metodologia] A amostragem e a análise de aldeído usaram a metodologia TO-11 da Agência de Proteção Ambiental dos Estados Unidos (EPA). As amostragens foram realizadas utilizando cartuchos de adsorção revestidos com uma solução de 2,4-DNFH, formando uma hidrazona com os aldeídos presentes na água da chuva e no ar. Elas foram analisadas usando um cromatógrafo líquido acoplado a um detector UV-Visível (HPLC-UV/Vis). Para a validação da técnica de análise e da qualidade analítica dos resultados, foram determinados: linearidade, sensibilidade, limites de quantificação, limites de detecção, repetibilidade, reprodutibilidade e porcentagem de recuperação. No caso da repetibilidade, foi utilizada a comparação do coeficiente de variação de Horwitz com os percentuais de desvio padrão relativo (% DER) das amostras. [Resultados] Os limites de detecção obtidos variam de 0,18 μg/m3 para acetaldeído e 3,20 μg/m3 no caso da acroleína, enquanto os limites de quantificação estão entre 0,62 μg/m3 para acetaldeído e 4,70 μg/m3 para o heptanal; dados que garantem a qualidade analítica do método. [Conclusões] De forma geral, o método de análise para aldeídos apresentou uma boa correlação linear, com valores de R2 igual ou superior a 0,9991 para cada curva de calibração, e valores percentuais de desvio relativo inferiores a 2,25%, o que indica boa acurácia na análise. Palavras-chave: aldeídos; chuva; cromatografia; validação; limites de detecção; limites de quantificação. |
Los aldehídos son componentes importantes de la química atmosférica y se forman por la degradación fotoquímica de otros compuestos orgánicos, mediante reacciones fotoquímicas en la tropósfera (Wade, 2012; Seinfeld y Pandis, 2006). También pueden ser emitidos a la atmósfera por fuentes biogénicas o antropogénicas (Peñuelas y Lluisa, 2002; Pichersky y Gershenzon, 2002; Luecken et al., 2012; Muños y Grau, 2013).
En relación con las fuentes naturales, particularmente en los ecosistemas forestales del trópico, existe una gran cantidad de compuestos orgánicos volátiles biogénicos (COVBs), los cuales comprenden alrededor del 90 % (1150 TgC/año) de las emisiones globales de los compuestos orgánicos volátiles (COV) (Mielke et al., 2010). Sus emisiones influyen en la producción de ozono troposférico, en la oxidación del metano y en la producción global de monóxido de carbono en el ciclo del carbono (Peñuelas y Lluisa, 2002).
Por otra parte, la mayoría de los hidrocarburos de origen antropogénico son emitidos por la combustión de vehículos y motores de combustión interna. La oxidación de estos origina diversos compuestos como aldehídos, cetonas, ácidos orgánicos, peróxidos, entre otros. La condensación de aldehídos y cetonas generan aerosoles de olor peculiar, que además limitan la visibilidad (Muños y Grau, 2013).
Para la recolección de muestras de aldehídos en aire y agua de lluvia se pueden tener opciones como impingers o burbujeadores (Guash, 1983; Hernández, 2001), denuders (Gallego et al., 2012; Vega, 2000) o mediante el uso de cartuchos de adsorción en fase sólida (Delgado, 2009; Herrington et al., 2005). Los análisis químicos posteriores para determinar la concentración de los aldehídos varían en función del tipo de equipo utilizado para el muestreo. En el caso de la captación de las muestras mediante el uso de impingers, el método de análisis recomendado es la espectrofotometría (Gasparini et al., 2008). Para muestras recolectadas por medio de denuders o cartuchos de adsorción, el método de análisis que mayor resultado ofrece es la cromatografía líquida de alta presión (HPLC) (Salazar, 2016). Con respecto al uso de la cromatografía de gases (GC), los aldehídos se calculan por medio de un agente derivatizante como el o–(2,3,4,5,6–pentafluorobencil)–hidroxilamina (PFBHA) en ácido clorhídrico (HCl). Los aldehídos reaccionan selectivamente con el agente derivatizante (PFBHA) para formar un complejo entre este y las oximas. La identificación de los compuestos se realiza al comparar los tiempos de retención de los patrones con los obtenidos de las muestras, la confirmación se realiza utilizando espectrometría de masas (Luo et al., 1992). Otro estudio como el de Asthana et al., (1998), en donde por electroforesis capilar con derivatización ácido hidrazino bencenosulfónico tuvo buenos resultados en la determinación dealdehídos por medio de la formación de la hidrazona.
En relación con el uso de la técnica de cromatografía líquida de alta resolución (HPLC) como metodología de análisis, es posible la cuantificación de aldehídos como: acroleína, benzaldehído, butiraldehído, crotonaldehído, formaldehído y propionaldehído, por la separación de sus derivados de 2,4-dinitrofenilhidrazona (2,4-DNPH). Se derivatizan las muestras con la 2,4-DNPH en HCl 0,1 mol/L y se extrae con cartuchos en acetonitrilo, para preconcentrar los compuestos. Posteriormente, se miden en una columna C18 de HPLC de fase inversa, con elución isocrática, utilizando acetonitrilo acuoso (65:35), y analizándose con detección ultravioleta (UV) a 360 nm (Peña et al., 2002).
Las técnicas anteriores son métodos analíticos cuyo alcance es la determinación y la cuantificación de aldehídos en matrices similares a muestras de aire y agua de lluvia. No obstante, no limita la cuantificación de aldehídos mediante la modificación de los métodos anteriores o inclusive mediante el desarrollo, validación e implementación de un nuevo método. Sin embargo, es importante resaltar que al utilizar un método fuera del alcance de la norma de referencia, se vuelve requisito la realización de estudios pertinentes para asegurar que el nuevo método continúa siendo técnicamente apto para su uso (Calderón et al., 2016). Según Taylor (1983), el proceso de validación tiene por objetivo verificar que la metodología utilizada se fundamenta en principios sólidos, ya sea que hayan sido planificados o modificados con fines prácticos de medición.
Entre los parámetros de desempeño utilizados o recomendados por otras personas autoras e investigadoras para la validación de un método están: ámbito de trabajo, linealidad, sensibilidad, precisión (reproducibilidad y respetabilidad intermedia), exactitud (recuperación), límite de detección (LD), límite de cuantificación (LQ) e incertidumbre de medición (Calderón et al., 2016; Taylor 1983; Ellison et al., 2009; Ramsey y Ellison, 2007; Burn, 2002; Barwick y Ellison, 2000; Miller y Miller, 2002).
En el presente trabajo de investigación se tiene como objetivo principal validar un método analítico que permita la cuantificación de muestras de aldehídos en matrices como aire y agua de lluvia.
Para el muestreo y el análisis de los aldehídos se utilizó la metodología TO-11A. planteada por la Agencia de Protección Ambiental de los Estados Unidos. El muestreo se realizó en el año 2017, en la Reserva Biológica Los Cusingos, ubicada en el Pacífico Sur, Pérez Zeledón. La reserva forma parte del Corredor Biológico Dr. Skutch, con las coordenadas 09°20’17’’ Norte y 83°37’37’’ Oeste, a una altura de 725 m s. n. m. La recolección de las muestras de aire se realizó con cartuchos de adsorción, los cuales son tubos de vidrio de 6 cm de longitud (con un diámetro interno de 0,4 cm), rellenos con 500 mg de octadecilo de sílice y recubiertos con una disolución de la 2,4-dinitrofenilhidrazina (2,4-DNFH) recristalizada.
El sistema de muestreo consistió en una bomba de diafragma que permite pasar el aire a través de los cartuchos, una trampa de seguridad para proteger la bomba de una posible entrada de agua, una válvula de punto crítico para regular el flujo de aire que entra al sistema y un filtro de fibra de vidrio. Se tomaron 45 muestras. El sistema de muestreo en el agua de lluvia fue con una botella de polietileno ámbar Nalgene de 1 L y un embudo de polietileno de espiga corta (lavados con ácido clorhídrico 1 mol/L y agua desionizada). La botella se colocó a 1,5 m del piso. Se tomaron siete muestras.
Para la validación se utilizaron cartuchos de adsorción recubiertos con una disolución de la 2,4-DNFH, formando una hidrazona con los aldehídos presentes en las disoluciones utilizadas. Posteriormente, fueron analizados mediante un cromatógrafo líquido acoplado a un detector UV-Visible. Las condiciones de análisis para determinar los aldehídos fueron las siguientes (EPA, 1999):
• Columna Agilent C18, 150 mm de longitud y 4,6 mm de diámetro interno.
• Detector Dionex UV-Vis.
• Temperatura del horno: 45 °C.
• Fase móvil: acetonitrilo: agua 60:40.
• Flujo: 1,2 mL/min.
• Longitud de onda (l = 365 nm).
• Volumen de inyección: 10 µL.
Se utilizó el programa Chromeleon 6.0 para determinar las áreas de los patrones y de las muestras. Por su parte, para la validación de la técnica de análisis y la garantía de la calidad analítica de los resultados se determinaron la linealidad, la sensibilidad, el límite de cuantificación, el límite de detección (obtenidos a partir de las curvas de calibración). Se evaluaron además otros parámetros como la repetibilidad, la reproducibilidad y el porcentaje de recuperación. Se utilizó el coeficiente de variación de Horwitz para comparar los porcentajes de desviación estándar relativo (%DER) de las muestras.
Para analizar la linealidad reportada por el equipo, se prepararon cinco curvas de calibración con la variación de la concentración de los aldehídos, dos curvas fueron generadas previo al muestreo y tres desarrolladas cada vez que se analizaron las muestras tomadas en el sitio de muestreo. El valor del coeficiente de determinación R2 de la curva de calibración se utilizó como criterio de linealidad. La sensibilidad se determinó a partir de la pendiente de la curva de calibración. Este valor corresponde a la gráfica de área de las muestras contra concentración de los patrones.
Con respecto al coeficiente de variación de Horwits, se hizo el análisis al reflexionar que la desviación estándar de uno de los patrones utilizados varía con la concentración del analito. Una aproximación para esta variación es el empleo de una relación funcional entre la concentración y la desviación estándar. La relación óptima que se conoce es la trompeta de Horwitz, la cual fue obtenida a partir de un estudio estadístico (Figura 1), para el cual el coeficiente de variación de los valores medios dados por diferentes laboratorios aumentaba conforme disminuía la concentración del analito, se demostró así que la desviación estándar relativa de un método varía con la concentración, de acuerdo con la Ecuación 1 (Miller y Miller, 2002).
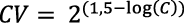 [Ecuación 1]
[Ecuación 1]
En la Ecuación 1, “CV” es el coeficiente de variación y “C” es la concentración de la muestra expresada como potencia de 10 (1 ppb = 10-9, 1 ppm = 10-6, 1 % = 10-2, 10 % = 10-1). Este cálculo se utilizó con el fin de determinar si los %DER se encontraban por debajo del CV de Horwitz. De este análisis se obtuvo el coeficiente de variación máximo esperado para las muestras de aire y de agua de lluvia.
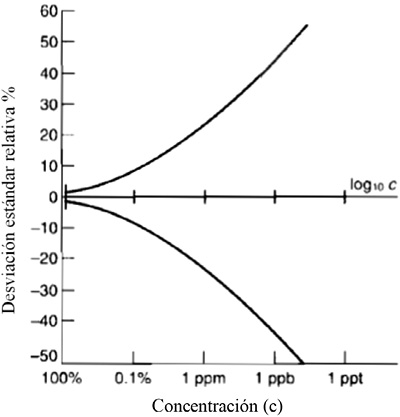
Nota: Tomado de Miller y Miller, 2002.
Por su parte, los valores del límite de detección (LD) límite de cuantificación (LC) se obtuvieron a partir del método estadístico propuesto por Miller y Miller (2002). El LD se determinó a partir de la desviación estándar del ajuste (sx/y) y el valor del intercepto (b) de la curva de calibración. Este se obtuvo de la concentración correspondiente a la respuesta calculada, utilizando el valor del intercepto del ajuste de calibración más tres veces la desviación estándar del ajuste a un nivel de confianza del 95 %, como se presenta en la Ecuación 2 (Miller y Miller, 2002). Para obtener el valor de la desviación estándar del ajuste (sx/y) se utilizó la Ecuación 3.
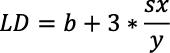 [Ecuación 2]
[Ecuación 2]
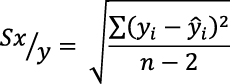 [Ecuación 3]
[Ecuación 3]
Donde:
y: valor obtenido de la curva de calibración de los estándares.
ŷi: valores de “y” ajustados por medio de la ecuación de la curva de calibración.
n: puntos de la curva de calibración.
El LC se determinó de manera análoga al LD; de acuerdo con Miller y Miller (2002), se expresa como la señal del intercepto más 10 veces su desviación estándar (Ecuación 4).
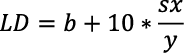 [Ecuación 4]
[Ecuación 4]
Estas respuestas son interpoladas en la ecuación de la curva de calibración para obtener la mínima concentración detectable y cuantificable (Miller y Miller, 2002). Para evaluar la repetibilidad se determinó el porcentaje de desviación estándar relativa (%DER), por medio de ocho repeticiones de un patrón mixto de (3,84 ± 0,58) mg/L de la hidrazona del formaldehído, acetaldehído, propanal y butanal, y de (7,0 ± 1,2) mg/L de la hidrazona del hexanal, heptanal y acroleína. El patrón fue utilizado el mismo día, por la misma persona analista, con el mismo equipo y bajo la misma metodología, en donde cada día se prepararon patrones para la curva de calibración.
Con el fin de determinar la reproducibilidad, se inyectó durante cinco días consecutivos un patrón mixto de (0,88 ± 0,14) mg/L de las hidrazonas de cada aldehído, por la misma persona analista, el mismo equipo y mediante la misma metodología. Se utilizó el porcentaje de recuperación como criterio de reproducibilidad, y se calculó por medio de la concentración obtenida de cada inyección entre la concentración del patrón de cada aldehído multiplicado por 100.
A su vez, se realizó un análisis de la estabilidad de la pendiente de las curvas de calibración de cada aldehído, para ello se evaluó la consistencia de las pendiente en diferentes curvas de calibración.
La preparación de la disolución de la 2,4-dinitrofenilhifrazina incluyó: a) la recristalización de la 2,4-DNFH, b) la preparación de la disolución madre de la 2,4-DNFH y c) la preparación de la disolución 0,40 mmol/L de 2,4-DNFH.
Con respecto a la recristalización de la 2,4-DNFH se procedió de la siguiente forma: se calentó un volumen de 600 mL de acetonitrilo grado HPLC a 80 °C, se disolvieron aproximadamente 10 g de cristales de la 2,4-DNFH hasta saturación. Se reposó la muestra durante tres horas, se enfrío a 0 °C y se filtró en un embudo Büchner. Se obtuvo un sólido de coloración rosada brillante, que posteriormente se secó en una estufa a 60 °C.
Por su parte, para preparar la disolución madre de la 2,4-DNFH se procedió a utilizar un vial de 10 mL en donde se disolvió 25 mg de los cristales de la 2,4-DNFH, obtenidos en 1 mL de acetonitrilo y 4 mL de ácido clorhídrico 5 mol/L. Esta disolución de 25 µmol/L se colocó durante una hora en un baño ultrasónico a 50 °C, hasta disolución completa. La disolución se almacenó en frío en un lugar oscuro.
Para preparar la disolución 0,40 mmol/L de 2,4-DNFH, esta se desgasificó por aproximadamente 15 minutos con nitrógeno limpio y se secó una mezcla de 32 mL de acetonitrilo y 164 mL de agua destilada y se le agregaron 3,2 mL de la disolución madre de la 2,4-DNFH.
Los cartuchos utilizados para el muestreo fueron tubos de vidrio de 6 cm de longitud, se rellenaron con 500 mg de octadecilo de sílice y se recubrieron con 2 mL de la disolución 0,40 mmol/L de la 2,4-DNFH. El pretratamiento de los cartuchos incluye su enjuague con 5 mL de acetonitrilo, posteriormente se agregó 2 mL de la disolución 0,40 mmol/L de la 2,4-DNFH y se enjuagaron de nuevo con 2 mL de acetonitrilo. Una vez preparados, se les agregó 3 mL de la disolución 0,40 mmol/L de la 2,4-DNFH. Al final, se secaron por aproximadamente cinco minutos con nitrógeno limpio y seco.
Una vez recubiertos los cartuchos, se sellaron con lámina de parafina, se cubrieron con papel de aluminio y se colocaron en un recipiente plástico cerrado. Posteriormente, se almacenaron refrigerados a menos de 4 °C.
Con el objetivo de preparar las curvas de calibración para el análisis de las muestras de aire y lluvia, se utilizaron las siguientes disoluciones estándar de cada aldehído con su respectivo porcentaje de pureza: formaldehído al 37 %, acetaldehído al 99 %, propanal al 99 %, butanal al 99 %, hexanal al 99 %, heptanal al 99 %, acroleína al 99 %, todas estas disoluciones fueron grado HPLC.
Las disoluciones estándares de las hidrazonas correspondientes a cada aldehído a partir de la 2,4-DNFH se prepararon en un matraz erlenmeyer de 25 mL, donde se disolvieron 0,2 g de la 2,4-DNFH en 1 mL de ácido sulfúrico concentrado; de seguido, se agregó gota a gota 1,5 mL de agua destilada con agitación hasta disolución completa. La mezcla se calentó ligeramente y se le añadieron 5 mL de etanol al 95 %. De forma paralela, se preparó una disolución de cada aldehído en etanol, disolviendo 0,25 g de compuesto en 10 mL de etanol al 95 %. Esta disolución se mezcló con la disolución de las hidrazonas, dejándose reposar durante 24 horas a temperatura ambiente. Transcurrido este tiempo se filtraron los sólidos y se secaron en una estufa a 60 °C.
Con respecto a la preparación de disoluciones madres de las hidrazonas se procedió de la siguiente forma: se pesó por separado 0,0010 g de la hidrazona de cada aldehído, las hidrazonas se disolvieron con acetonitrilo grado HPLC, se trasvasaron cuantitativamente a balones aforados de 10 mL y se llevaron a la marca de aforo con acetonitrilo. Luego, se mezclaron las disoluciones madre de los aldehídos y se hizo pasar la disolución por cada cartucho ya acondicionado con la 2,4-DNFH, para que se diera la reacción. Después, se extrajeron las hidrazonas con 2 mL de la disolución de acetonitrilo.
Con respecto a los seis patrones de los aldehídos utilizados, estos se prepararon a partir de las disoluciones madres de las hidrazonas. La curva de calibración se preparó con: 0,2 mg/L, 0,4 mg/L, 0,8 mg/L, 1,6 mg/L, 3,2 mg/L y 6,4 mg/L de la hidrazona del formaldehído, del acetaldehído, del propanal y del butanal, y con: 0,4 mg/L, 0,8 mg/L, 1,6 mg/L, 3,2 mg/L, 6,4 mg/L y 12,8 mg/L de la hidrazona del hexanal, del heptanal y de la acroleína. Los cartuchos que se utilizaron como blancos se acondicionaron de la misma manera que aquellos para las muestras.
La Figura 2 muestra un ejemplo de cromatograma obtenido por la inyección de los patrones de las hidrazonas. La Tabla 1 presenta las concentraciones de las disoluciones madres de hidrazonas preparadas para cada aldehído. Las disoluciones patrón preparadas a partir de la disolución madre se exponen la Tabla 2, con su respectiva incertidumbre.
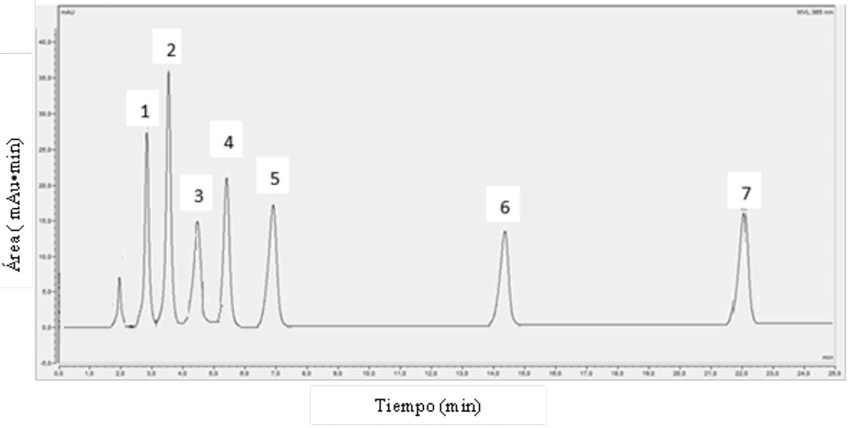
Figura 2. Cromatograma representativo de los aldehídos analizados por cromatografía líquida acoplada a un detector UV-Visible a una longitud de onda de 365 nm. Donde 1= Formaldehído, 2= Acetaldehído, 3= Acroleína, 4= Propanal, 5= Butanal, 6= Hexanal, 7= Heptanal
Nota: elaboración propia.
Tabla 1. Concentración e incertidumbre de las hidrazonas de cada aldehído en las disoluciones madres utilizadas para el control de la calidad analítica
|
Aldehído |
Concentración disolución madre (mg•L-1) |
|
Formaldehído |
17,1 ± 2,5 |
|
Acetaldehído |
23,6 ± 3,5 |
|
Propanal |
26,8 ± 4,3 |
|
Butanal |
34,3 ± 5,0 |
|
Hexanal |
39,3 ± 6,3 |
|
Heptanal |
42,7 ± 6,8 |
|
Acroleína |
28,5 ± 4,2 |
Nota: elaboración propia.
Tabla 2. Concentración e incertidumbre de cada aldehído en las disoluciones patrón utilizadas para la confección de las curvas de calibración
|
Patrón |
Formaldehído (mg•L-1) |
Acetaldehído (mg•L-1) |
Propanal (mg•L-1) |
Butanal (mg•L-1) |
Hexanal (mg•L-1) |
Heptanal (mg•L-1) |
Acroleína (mg•L-1) |
|
1 |
0,0343 ± 0,0050 |
0,0472 ± 0,0070 |
0,0536 ± 0,0086 |
0,069 ± 0,010 |
0,157 ± 0,025 |
0,171 ± 0,027 |
0,114 ± 0,017 |
|
2 |
0,069 ± 0,010 |
0,094 ± 0,014 |
0,107 ± 0,017 |
0,137 ± 0,020 |
0,314 ± 0,050 |
0,341 ± 0,054 |
0,228 ± 0,034 |
|
3 |
0,137 ± 0,020 |
0,189 ± 0,028 |
0,215 ± 0,034 |
0,274 ± 0,040 |
0,63 ± 0,10 |
0,68 ± 0,11 |
0,456 ± 0,067 |
|
4 |
0,274 ± 0,040 |
0,377 ± 0,056 |
0,429 ± 0,069 |
0,549 ± 0,080 |
1,26 ± 0,20 |
1,37 ± 0,22 |
0,91 ± 0,13 |
|
5 |
0,549 ± 0,080 |
0,75 ± 0,11 |
0,86 ± 0,14 |
1,10 ± 0,16 |
2,52 ± 0,40 |
2,73 ± 0,44 |
1,82 ± 0,27 |
|
6 |
1,10 ± 0,16 |
1,51 ± 0,22 |
1,72 ± 0,28 |
2,20 ± 0,32 |
5,03 ± 0,81 |
5,46 ± 0,87 |
3,65 ± 0,54 |
Nota: elaboración propia.
La Tabla 3 evidencia los valores del coeficiente de determinación (R2) para cada uno de los aldehídos analizados, estos valores están muy cercanos entre sí, además de presentar una alta proximidad al valor ideal de 1. De acuerdo con Harris (2007) un valor de R2 por encima de 0,995 es considerado un ajuste adecuado para la mayoría de los fines analíticos. Por lo tanto, los datos obtenidos en los análisis representan una linealidad y una relación concentración-área aceptable.
Tabla 3. Coeficiente de determinación (R2) de las distintas curvas de calibración para el control de la calidad analítica
|
Coeficiente de determinación (R²) |
|||||||
|
Curva |
Formaldehído |
Acetaldehído |
Propanal |
Butanal |
Hexanal |
Heptanal |
Acroleína |
|
1 |
0,9995 |
0,9999 |
0,9995 |
0,9998 |
0,9996 |
0,9996 |
0,9995 |
|
2 |
0,9997 |
0,9998 |
0,9998 |
0,9995 |
0,9993 |
0,9998 |
0,9996 |
|
3 |
0,9996 |
0,9998 |
0,9994 |
0,9993 |
0,9995 |
0,9996 |
1,0000 |
|
4 |
0,9991 |
0,9999 |
0,9996 |
0,9998 |
0,9997 |
0,9998 |
0,9997 |
|
5 |
0,9991 |
0,9994 |
0,9994 |
0,9996 |
0,9995 |
0,9999 |
0,9995 |
|
Promedio |
0,9994 |
0,9998 |
0,9995 |
0,9996 |
0,9995 |
0,9997 |
0,9997 |
Nota: elaboración propia.
Con respecto a la sensibilidad de método, en la Tabla 4 se detallan los valores de las pendientes de las curvas de calibración de los aldehídos analizados. La sensibilidad de calibración mide la capacidad de un método para distinguir pequeñas diferencias en la concentración de un analito, la cual corresponde a la pendiente de la curva de calibración obtenida a partir de la gráfica del área contra concentración (Sierra et al., 2010). De acuerdo con Castillo y colaboradores (1996) entre mayor sea la pendiente, mayor será la sensibilidad del método.
De acuerdo con lo presentado en la Tabla 4, tanto el propanal como el acetaldehído tienen las mejores sensibilidades, con valores promedios de pendiente de 10,5379 y 9,7693 respectivamente. Por su parte el menor valor de pendiente promedio fue para el heptanal, con un valor de 2,8558. Para el caso de la curva del formaldehido y el propanal no hay evidencia estadísticamente significativa, al 95 % de confianza, que indique que las pendientes son iguales a diferentes ámbitos de trabajo. Esto sugiere la existencia de una falta de estabilidad en la relación entre estas variables. En el caso de las demás curvas, el ámbito de trabajo fue el mismo, por lo que no se puede especificar los cambios en la pendiente producto de la variación en el intervalo de trabajo, sin embargo, se evidencia igualdad de pendientes en los diferentes ensayos realizados a un 95 % de confianza
Tabla 4. Pendientes de las curvas de calibración de los aldehídos analizados en este estudio
|
Curva |
Formaldehído |
Acetaldehído |
Propanal |
Butanal |
Hexanal |
Heptanal |
Acroleína |
|
1 |
7,0799 |
10,4410 |
8,8121 |
5,5722 |
4,5362 |
2,8425 |
4,1748 |
|
2 |
8,8998 |
9,7071 |
10,1170 |
5,6550 |
4,9790 |
2,8468 |
4,2353 |
|
3 |
8,6292 |
9,4057 |
11,3520 |
5,4529 |
4,6778 |
2,7376 |
4,5790 |
|
4 |
7,7112 |
9,6674 |
11,3030 |
5,8076 |
5,1688 |
2,9317 |
4,7157 |
|
5 |
7,9447 |
9,7601 |
11,1040 |
5,9151 |
5,1067 |
2,9205 |
4,7295 |
|
Promedio |
8,0530 |
9,7963 |
10,5376 |
5,6806 |
4,8937 |
2,8558 |
4,4869 |
Nota: elaboración propia.
La Tabla 5 muestra los resultados del coeficiente de variación de Horwitz (expresado como %DER) y los valores de área para un patrón mixto, ambos datos utilizados para determinar la repetibilidad.
Este coeficiente se determinó con el fin de establecer los valores máximos de %DER que las muestras de aldehídos podrían obtener, al compararlos. Todos los valores (Tabla 5) están por debajo del coeficiente de variación establecido por Horwitz, lo cual indica que las mediciones de las muestras de los aldehídos no deben repetirse.
Ahora bien, en la Tabla 5 los valores del área obtenida y el %DER para las ocho repeticiones de las inyecciones (realizadas en un mismo día) para un patrón mixto de (3,84 ± 0,58) mg/L de la hidrazona del formaldehído, acetaldehído, propanal y butanal), y de (7,0 ± 1,2) mg/L de la hidrazona del hexanal, heptanal y acroleína). Se observa que los valores del %DER están por debajo del 2 %, esto significa que la precisión del método es aceptable (Sierra et al., 2010), con excepción del acetaldehído y del propanal. Sin embargo, los valores de %DER de estudios similares reportados por Salazar (2016) están entre 2 % y un 5 %, mientras los obtenidos por Vega (2000) se encuentran entre el 10 % y el 13 %. Esto indica que el presente método de análisis es más preciso, comparados con Salazar (2016) y Vega (2000), siendo aceptable para el alcance del estudio, pues se trata de muestras ambientales, que poseen una alta variabilidad en su composición.
Tabla 5. Áreas de un patrón mixto de los aldehídos a analizar por HPLC en un acoplado a un detector ultravioleta para la determinación de la repetibilidad
|
Área (± 0,050 mAu•min) |
|||||||
|
Repetición |
Formaldehído |
Acetaldehído |
Acroleína |
Propanal |
Butanal |
Hexanal |
Heptanal |
|
1 |
4,760 |
7,220 |
8,080 |
7,640 |
5,760 |
12,550 |
7,660 |
|
2 |
4,670 |
6,660 |
8,280 |
7,180 |
5,930 |
12,690 |
7,690 |
|
3 |
4,780 |
6,930 |
8,460 |
7,240 |
5,790 |
12,680 |
7,370 |
|
4 |
4,750 |
6,940 |
8,480 |
7,300 |
5,870 |
12,610 |
7,670 |
|
5 |
4,710 |
6,850 |
8,300 |
7,160 |
5,980 |
12,70 |
7,520 |
|
6 |
4,710 |
6,850 |
8,420 |
7,340 |
5,850 |
12,620 |
7,460 |
|
7 |
4,720 |
6,930 |
8,410 |
7,270 |
5,820 |
12,630 |
7,620 |
|
8 |
4,690 |
6,870 |
8,450 |
7,210 |
5,860 |
12,660 |
7,670 |
|
Promedio (± 0,050) |
4,720 |
6,910 |
8,360 |
7,290 |
5,860 |
12,640 |
7,580 |
|
Desviación estándar (± 0,005) |
0,037 |
0,155 |
0,135 |
0,153 |
0,072 |
0,050 |
0,119 |
|
%DER (± 0,11) |
0,78 |
2,25 |
1,61 |
2,09 |
1,22 |
0,40 |
1,56 |
Nota: elaboración propia.
El porcentaje de recuperación de los aldehídos por el método de HPLC acoplado a un detector ultravioleta (Tabla 6) se determinó mediante la inyección de un patrón mixto de (0,88 ± 0,14) mg/L de las hidrazonas de cada aldehído durante cinco días consecutivos para tener cinco repeticiones de cada patrón. La Tabla 6 presenta valores de porcentajes de recuperación entre el 94 % y el 107 % para los aldehídos analizados. El propanal fue el analito con los porcentajes de recuperación más bajos, con valores entre el 94 % y el 97 %; mientras que el hexanal reportó valores más altos, con recuperaciones entre un 98 % y un 107 %. Esto indica que el método es reproducible y apto para el análisis a efectuar, pues los porcentajes de recuperación están cercanos al 100 % de respuesta.
Tabla 6. Porcentaje de recuperación, límite de detección y límite de cuantificación de los aldehídos por el método de HPLC acoplado a un detector ultravioleta
|
Concentración nominal por aldehído (mg•L-1) |
Porcentaje de recuperación (%) |
Límites de detección |
Límites de cuantificación |
||
|
Concentración (μg•m-3) |
Concentración (μg•m-3) |
||||
|
Mínimo |
Mínimo |
Mínimo |
Máximo |
||
|
Formaldehído (0,1372 mg•L-1) |
97 a 104 |
0,22 |
0,70 |
0,70 |
1,1 |
|
Acetaldehído (0,1887 mg•L-1) |
96 a 99 |
0,18 |
0,62 |
0,62 |
1,8 |
|
Acroleína (0,2279 mg•L-1) |
95 a 101 |
0,25 |
0,83 |
0,83 |
1,6 |
|
Propanal (0,2146 mg•L-1) |
94 a 98 |
0,35 |
1,2 |
1,2 |
2,2 |
|
Butanal (0,2744 mg•L-1) |
98 a 102 |
0,95 |
3,2 |
3,2 |
4,6 |
|
Hexanal (0,3145 mg•L-1) |
98 a 107 |
0,80 |
2,7 |
2,7 |
4,7 |
|
Heptanal (0,3414 mg•L-1) |
95 a 99 |
0,25 |
0,8 |
0,8 |
3,2 |
Nota: elaboración propia.
En la Tabla 6 se muestran los valores mínimos y máximos para los límites de detección y cuantificación de cada aldehído estudiado. Estos valores son el resultado de las cinco curvas de calibración utilizadas en la validación del método analítico. De acuerdo con la Tabla 6, el acetaldehído con 0,18 μg/m3 es el compuesto con el menor valor de límite de detección, mientras que la acroleína tiene el mayor límite de detección, el cual es de 3,2 μg/m3. Con respecto al límite de cuantificación (Tabla 6), el acetaldehído es el compuesto con la mínima concentración cuantificable (0,62 μg/m3), siendo el heptanal el que presenta el mayor límite de cuantificación (4,7 μg/m3). De acuerdo con los resultados reportados en ambas tablas, los valores de los límites de detección de los aldehídos oscilan entre 0,18 μg/m3 y 3,20 μg/m3, mientras que los límites de cuantificación están entre 0,62 μg/m3 y 4,70 μg/m3. Estos valores son aceptables si se compara con las metodologías realizadas por otros estudios (Salazar et al., 2016; Guimaraes et al., 2010; Yu et al., 2008; Vega, 2000; Khare et al., 1997).
Con respecto al cálculo de coeficiente de correlación de Pearson, se obtuvo un valor de 0,576. En el presente estudio se obtuvo este dato (r) mediante el uso del programa estadístico InfoStat (Di Rienzo et al., 2018), con un valor de n = 12 y un valor de confianza α = 0,05 [24]. Se debe indicar que el coeficiente de correlación de Pearson mide la fuerza de la relación lineal entre valores cuantitativos apareados “x” y “y” en una muestra. El valor de “r” siempre debe estar entre 1 y -1. Al comparar el valor “r” obtenido por el método con los valores críticos del coeficiente de correlación de Pearson r se concluye que existe una correlación lineal significativa (Triola, 2004).
Concentración de aldehídos en aire
El formaldehído fue el compuesto con mayor abundancia porque es un producto de la oxidación fotoquímica de los hidrocarburos y de los COV emitidos por la vegetación. Además, este hecho podría deberse a las fuentes de emisión primarias, tanto biogénicas como antropogénicas. La Tabla 7 presenta la concentración de los aldehídos muestreados y analizados por la metodología validada.
Tabla 7. Concentración de los aldehídos en aire en la Reserva Biológica Los Cusingos
|
Lugar |
Concentración promedio de aldehídos (μg•m-3) |
Período de muestreo |
||||||
|
F |
A |
Acr |
P |
B |
Hx |
Hp |
||
|
Reserva Biológica Los Cusingos, Costa Rica |
26,8 |
38,5 |
48,3 |
3,05 |
9,1 |
11,0 |
1,70 |
Junio-Julio 2017 |
Nota: elaboración propia.
Concentración de aldehídos en el agua de lluvia
La principal fuente de los aldehídos en el agua de lluvia es la producción fotoquímica en la atmósfera a partir de hidrocarburos antropogénicos o biogénicos naturales. La Tabla 8 muestra las concentraciones de los aldehídos en el agua de lluvia de las muestras recolectadas en la Reserva Biológica Los Cusingos. El único aldehído que se pudo cuantificar durante los días de precipitación corresponde al formaldehído; el acetaldehído se reportó por debajo del límite de cuantificación y los demás aldehídos, por debajo del límite de detección.
Tabla 8. Concentración de los aldehídos en el agua de lluvia recolectada en la Reserva Biológica Los Cusingos durante las tres campañas de muestreo, y en Las Nubes
|
Fecha |
Reserva Biológica Los Cusingos |
Proyecto Las Nubes |
|
|
Formaldehído (mg/L) |
Acetaldehído (mg/L) |
Formaldehído (mg/L) |
|
|
19/06/2017 |
0,0548 ± 0,0062 |
< LC = 0,015 |
NA |
|
20/06/2017 |
0,0544 ± 0,0062 |
< LC = 0,015 |
NA |
|
22/06/2017 |
0,0439 ± 0,0062 |
< LC = 0,015 |
NA |
|
03/07/2017 |
0,0530 ± 0,0041 |
< LC = 0,032 |
NA |
|
06/07/2017 |
0,0623 ± 0,0041 |
< LC = 0,032 |
NA |
|
07/07/2017 |
0,0623 ± 0,0041 |
< LC = 0,032 |
NA |
|
21/07/2017 |
0,08 ± 0,13 |
< LC = 0,011 |
0,08 ± 0,13 |
LC: Límite de cuantificación NA: No analizado
Nota: elaboración propia.
El método de análisis para los aldehídos (formaldehido, acetaldehído, propanal, butanal, hexanal, heptanal y acroleína) mostró buena linealidad, con valores de R2 igual o mayores a 0,9991 para cada curva de calibración, y valores de porcentajes de desvío relativo menores al 2,25 %, lo cual indica una buena precisión en el análisis.
El porcentaje de recuperación para cada aldehído osciló entre el 94 % y el 107 %. El propanal mostró un porcentaje de recuperación menor, con valores entre el 94 % y el 97 %. Por su parte, los mayores valores pertenecen al hexanal, con recuperaciones entre un 98 % y un 107 %. Esto implica que el método es reproducible y apto para la cuantificación de los aldehídos en muestras de aire y agua de lluvia.
El acetaldehído fue el compuesto con el menor valor de límite de detección (0,18 μg/m3), mientras que la acroleína presentó el mayor límite de detección (3,2 μg/m3). Con respecto al límite de cuantificación, el acetaldehído es el compuesto con la mínima concentración cuantificable (0,62 μg/m3), siendo el heptanal el que presentó el mayor límite de cuantificación (4,7 μg/m3).
Universidad Nacional, Costa Rica. 0245-13, Determinación de la concentración de aldehídos en aire en un bosque primario (Reserva Biológica Monteverde) y en una zona urbana (alrededores de la Universidad Nacional).
A las personas autoras les gustaría agradecer al Centro Científico Tropical (CCT) y sus colaboradores de la Reserva Biológica Los Cusingos por permitir el libre acceso a la reserva para la toma de muestras. Además, agradecer a los administradores del Proyecto Las Nubes, Facultad de Estudios Ambientales de la Universidad de York, Canadá, por la colaboración y permitir que se tomarán muestras de agua de lluvia en sus instalaciones.
Las personas autoras declaran no tener algún conflicto de interés.
Declaración de la contribución de las personas autoras
El porcentaje total de contribución para la conceptualización, la preparación y la corrección de este artículo fue el siguiente: M. A. A. 20 %, J. P. S. B. 15 %, R. S. F. 15 %, J. C. M. B. 10 %, R. A. S. 15 %, H. B. A. 10 % y J. V. G. 15 %.
Declaración de disponibilidad de los datos
Los datos que respaldan los resultados de este estudio serán puestos a disposición por el autor correspondiente J. P. S. B., previa solicitud razonable.
Una versión Preprint de este artículo fue depositada en: https://repositorio.una.ac.cr/handle/11056/25982
Asthana, A., Bose, D., Kulshrestha, S., Pathak, S., Sanghi, S. y Kok, W. (1998). Determination of aldehydes in water samples by capillary electrophoresis after derivatization with hydrazino benzene sulfonic acid. Chromatographia, 48(11-12), 807-810. https://doi.org/10.1007/BF02467652
Barwick, V. J. y Ellison, S. L. R. (2000). Development and Harmonisation of Measurement Uncertainty Principles: Part (d): Protocol for uncertainty evaluation from validation data. Ediciones VAM.
Burns, D. T., Danzer, K. y Townshend, A. (2002). Use of the term “recovery” and “apparent recovery” in analytical procedures (IUPAC Recommendations 2002). Pure and Applied Chemistry, 74(11), 2201-2205. https://doi.org/10.1351/pac200274112201
Calderón, B., Venegas, J., Sibaja, J. P., Salazar, J. y Rodríguez, E. (2016). Determinación del contenido de plomo, cromo y mercurio total a nivel traza en matriz de cemento mediante las técnicas analíticas de FAAS, GFAAS y CVAAS: Validación del método de ensayo. Métodos & Materiales, 6(1), 1-18. https://doi.org/10.15517/MYM.V6I1.29700
Castillo, B. y González, R. (1996). Protocolo de validación de métodos analíticos para la cuantificación de fármacos. Revista Cubana de Farmacia, 30(1). http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75151996000100009
Delgado, B. (2009). Compuestos carbonílicos en muestras de interés medioambiental y agroalimentario. (Tesis de Doctorado). Universidad de la Laguna, España.
Di Rienzo, J. A., Casanoves, F., Balzarini, M. G., González, L., Tablada, M. y Robledo C. W. (2018). InfoStat. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. http://www.infostat.com.ar
Environmental Protection Agency (EPA). (1999). Compendium of Methods for the Determination of Toxic Organic Compounds in Ambient Air. U.S. Environmental Protection Agency. https://www3.epa.gov/ttnamti1/files/ambient/airtox/to-11ar.pdf
Ellison, S., Barwick, V. y Duguid, T. (2009). Practical Statistics for the Analytical Scientist: A Bench Guide. Ediciones The Royal Society of Chemistry.
Gallego, A., González, I., Sánchez, B., Fernández, P., Garcinuño, R., Bravo, J., Pradana, J., García, M. y Durand, J. (2012). Contaminación Atmosférica. Ediciones Universidad Nacional de Educación a Distancia.
Gasparini, F., Weinert, P., Lima, L., Pezza, L. y Pezza, H. (2008). A simple and green analytical method for the determination of formaldehyde. Journal of the Brazilian Chemical Society, 19(8), 1531-1537. https://doi.org/10.1590/S0103-50532008000800012
Guash, J. (1983). NTP 138: Pérdida de carga de los soportes de retención. Centro de Investigación y Asistencia Técnica de Barcelona. http://www.insht.es/InshtWeb/Contenidos/Documentacion/FichasTecnicas/NTP/Ficheros/101a200/ntp_138.pdf
Guimaraes, C., Custodio, D., Oliveira, R., Varandas, L. y Arbilla, G. (2010). Comparative study of automotive, aircraft and biogenic emissions of aldehydes and aromatic compounds. Bulletin of Environmental Contamination and Toxicology, 84(2), 180-184. https://doi.org/10.1007/s00128-009-9891-5
Harris, D. (2007). Análisis Químico Cuantitativo. Ediciones Reverté.
Hernández, A. (2001). NTP 609: Agentes biológicos: equipos de muestreo (I). Centro Nacional de Condiciones de Trabajo. http://www.insht.es/InshtWeb/Contenidos/Documentacion/FichasTecnicas/NTP/Ficheros/601a700/ntp_609.pdf
Herrington, J., Zhang, L., Whitaker, D., Sheldon, L. y Zhang, J. (2005). Optimizing dansylhydrazine (DNSH) based method for measuring airborne acrolein and other unsaturated carbonyls. Journal of Environment Monitoring, 7(10), 969-976. https://doi.org/10.1039/B502063H
Khare, P. P., Satsangi, P. G., Kumar, N. N., Kumari, M. M. y Srivastava, S. S. (1997). HCHO, HCOOH and CH3COOH in air and rainwater at a rural tropical site in North Central India. Atmospheric Environment, 31(23), 3867-3875. https://doi.org/10.1016/S1352-2310(97)00263-X
Luecken, D., Hutzell, W., Strum, M. y Pouliot, G. (2012). Regional sources of atmospheric formaldehyde and acetaldehyde, and implications for atmospheric modeling. Atmospheric Environment, 47, 477-490. https://doi.org/10.1016/j.atmosenv.2011.10.005
Luo, X., Yazdanpanah, M., Bhooi, N. y Lehotay, D. (1992). Determination of aldehydes and other lipid peroxidation products in biological samples by gas chromatography-mass spectrometry. Analytical Biochemmistry, 228(2), 294-298. https://doi.org/10.1006/abio.1995.1353
Mielke, L., Pratt, K., Shepson, P., McLuckey, S., Wisthaler, A. y Hansel, A. (2010). Quantitative determination of biogenic volatile organic compounds in the atmosphere using proton-transfer reaction linear ion trap mass spectrometry. Analytical Chemistry, 82(19), 7952-7957. https://doi.org/10.1021/ac1014244
Miller, J. y Miller, J. (2002). Estadística y Quimiometría para Química Analítica. Ediciones Pearson Education.
Muños, E. y Grau, M. (2013). Ingeniería Química. Ediciones Universidad Nacional de Educación a Distancia.
Peña, R., García, S., Herrero, C., Losada, M., Vásquez, A. y Lucas, T. (2002). Organic acids and aldehydes in rainwater in a northwest region of Spain. Atmospheric Environment, 36(34), 5277-5288. https://doi.org/10.1016/S1352-2310(02)00648-9
Peñuelas, J. y Llusià, J. (2002). Linking photorespiration, monoterpenes and thermotolerance in Quercus. New Phytologist, 155(2), 227-228. https://doi.org/10.1046/j.1469-8137.2002.00457.x
Pichersky, E. y Gershenzon, J. (2002). The formation and function of plant volatiles: perfumes for pollinator attraction and defense. Current Opinion in Plant Biology, 5(3), 237-243. https://doi.org/10.1016/s1369-5266(02)00251-0
Salazar, B. (2016). Evaluación de la concentración de aldehídos en el aire de la Reserva Biológica Monteverde y del Campus Omar Dengo de la Universidad Nacional, durante la época seca y la lluviosa. (Tesis de Licenciatura). Universidad Nacional, Costa Rica.
Seinfeld, J. y Pandis, S. (2006). Atmospheric Chemistry and Physics from Air Pollution to Climate Change. Ediciones John Wiley & Sons.
Sierra, I., Gómez, S., Pérez, D. y Morante, S. (2010). Análisis Instrumental. Algunas herramientas de enseñanza-aprendizaje adoptadas al Espacio Europeo de Educación Superior. Ediciones Gesbiblo.
Ramsey, M. H. y Ellison, S. L. (2007). Eurachem/EUROLAB/ CITAC/Nordtest/AMC Guide: Measurement uncertainty arising from sampling: a guide to methods and approaches. Ediciones Eurechem.
Taylor, J. K. (1983). Validation of analytical methods. Analytical Chemistry, 55(6), 600A-608A. https://doi.org/10.1021/ac00257a721
Triola, M. (2004). Estadística. Ediciones Pearson Education.
Vega, D. (2000). Aplicación de dos técnicas analíticas de muestreo para la determinación de aldehídos en aire y en agua de lluvia en tres zonas de Costa Rica. (Tesis de Maestría). Universidad Nacional, Costa Rica.
Wade, L. (2012). Química Orgánica. Ediciones Pearson Education.
Yu, Y., We, S., Lu, H., Feng, Y., Wang, X., Sheng, G. y Fu, J. (2008). Characteristics of atmospheric carbonyls and VOCs in Forest Park in South China. Environmental Monitoring and Assessment, 137(1-3), 275-285. https://doi.org/10.1007/s10661-007-9759-2
1* Autor para correspondencia
Melissa Araya Araya,
 melissa.araya.araya@una.est.ac.cr,
melissa.araya.araya@una.est.ac.cr,  https://orcid.org/0000-0002-6866-9603
https://orcid.org/0000-0002-6866-9603José Pablo Sibaja Brenes,
 jose.sibaja.brenes@una.cr,
jose.sibaja.brenes@una.cr,  https://orcid.org/0000-0002-7056-2717
https://orcid.org/0000-0002-7056-2717Roy Soto Fallas,
 roy.soto.fallas@una.ac.cr,
roy.soto.fallas@una.ac.cr,  https://orcid.org/0000-0001-6983-540X
https://orcid.org/0000-0001-6983-540XJosé Carlos Mora-Barrantes,
 jose.mora.barrantes@una.cr,
jose.mora.barrantes@una.cr,  https://orcid.org/0000-0002-0409-5276
https://orcid.org/0000-0002-0409-5276Rosa Alfaro Solís,
 rosa.alfaro.solis@una.cr,
rosa.alfaro.solis@una.cr,  https://orcid.org/0000-0001-7413-4210
https://orcid.org/0000-0001-7413-4210Henry Borbón-Alpízar,
 henry.borbon.alpizar@una.cr,
henry.borbon.alpizar@una.cr,  https://orcid.org/0000-0003-0869-4126
https://orcid.org/0000-0003-0869-4126Juan Valdés González,
 juanvalde@gmail.com,
juanvalde@gmail.com,  https://orcid.org/0000-0002-8641-927X
https://orcid.org/0000-0002-8641-927XLaboratorio de Química de la Atmósfera, Escuela de Química, Universidad Nacional, Heredia, Costa Rica.
2 Laboratorio de Productos Naturales y Ensayos Biológicos, Escuela de Química, Universidad Nacional, Heredia, Costa Rica.
Validación de un método de cromatografía líquida (HPLC-UV/Vis) para la cuantificación de aldehídos en agua de lluvia y aire (Melissa Araya Araya • José Pablo Sibaja Brenes • Roy Soto Fallas • José Carlos Mora-Barrantes • Rosa Alfaro Solís • Henry Borbón-Alpízar • Juan Valdés González) Uniciencia is protected by Attribution-NonCommercial-NoDerivs 3.0 Unported (CC BY-NC-ND 3.0)
URL: www.revistas.una.ac.cr/uniciencia
Correo electrónico: revistauniciencia@una.cr


