
Rev. Ciencias Veterinarias, Vol. 38, N° 1, [1-16], E-ISSN: 2215-4507, enero-junio, 2020
DOI: https://doi.org/10.15359/rcv.38-1.1
URL: http://www.revistas.una.ac.cr/index.php/veterinaria/index
Aspectos epidemiológicos de la brucelosis en humanos en las Áreas Rectoras Aguas Zarcas y Los Chiles, Costa Rica, ٢٠١٥-٢٠١٧
Epidemiological aspects of brucellosis in humans in the Health Areas of Aguas Zarcas and Los Chiles, Costa Rica, 2015-2017
Aspectos epidemiológicos da brucelose em humanos em Áreas Reitoras de Aguas Zarcas e Los Chiles, Costa Rica, 2015-2017
Claudia Rosales Galeano1, Claudia Puentes Mojica2, Oldemar Arias Rojas3, Juan José Romero Zúñiga4
1 Área Rectora de Salud Los Chiles, Ministerio de Salud, Alajuela, Costa Rica. E-mail: claudia.rosales@misalud.go.cr
2 Dirección Región Huetar Norte, Ministerio de Salud, Alajuela, Costa Rica. E-mail: claudia.puentes@misalud.go.cr
3 Área Rectora de Salud Aguas Zarcas, Ministerio de Salud, Alajuela, Costa Rica. E-mail: oldemar.arias@misalud.go.cr
4 Posgrado Regional en Ciencias Veterinarias. Universidad Nacional, Heredia, Costa Rica. E-mail: juan.romero.zuniga@una.cr. Telefax: (506) 22602155
 Autor para correspondencia: juan.romero.zuniga@una.cr
Autor para correspondencia: juan.romero.zuniga@una.cr
Recibido: 10 de abril de 2019 Corregido: 28 de octubre de 2019 Aceptado: 30 de octubre de 2019
Resumen
La brucelosis es una enfermedad zoonótica causada por especies del género Brucella spp., con baja notificación y subregistro en Costa Rica, especialmente en personas y en bovinos. Se determina la seroprevalencia para Brucella spp. lisas y factores de riesgo asociados, en personas que habitan o trabajan en fincas ganaderas positivas a brucelosis bovina de las Áreas Rectoras de Salud de Aguas Zarcas y Los Chiles, Alajuela, entre ٢٠١٥ y ٢٠١٧, mediante un estudio transversal analítico. Se toma una muestra sanguínea a las personas estudiadas y se les aplica una encuesta, previo consentimiento informado. Las muestras son analizadas, en paralelo, mediante las pruebas de Rosa de Bengala y sero aglutinación (SAT). Se realiza estadística descriptiva de los factores personales, culturales y ambientales, asociados con el riesgo a brucelosis. Además, se estima razones de posibilidades (Odds ratio) mediante regresión logística no condicional, para determinar factores asociados con su estado serológico. La seroprevalencia para Brucella spp. lisas es 12.5%. La elaboración de alimentos con productos lácteos no pasteurizados (OR=11.0; IC 95%: 3.0-39.9); la inseminación artificial sin protección adecuada (OR=8.84; IC 95%: 1.8-43.5); la atención de partos sin protección básica (OR=3.9; IC 95%: 1.1-14.1) y el consumo de helados caseros, fabricados con leche sin pasteurizar (OR=7.9; IC 95%: 2.7-22.6), representan los principales factores de riesgo. Otros factores muestran tendencia al riesgo, pero es posible que la baja muestra haya afectado la potencia estadística de las estimaciones. Se demuestra una importante exposición a Brucella spp. lisas en quienes laboran y viven en fincas de ganado bovino, con animales seroreactores a Brucella abortus, por la realización de prácticas culturales de riesgo. La diferencia cuantitativa, entre los casos notificados al sistema de vigilancia epidemiológica del Ministerio de Salud (Ministerio de Salud 2015; Ministerio de Salud 2016), con los resultados de este estudio, indican que se debe reforzar la inclusión de esta enfermedad como diagnóstico diferencial para casos de enfermedad febril aguda, e instaurar un sistema de vigilancia epidemiológica eficaz y eficiente.
Palabras clave: Salud pública, epidemiología, factores de riesgo, vigilancia epidemiológica, zoonosis, Una Salud.
Abstract
Brucellosis is a zoonotic disease caused by species of genus Brucella spp., with low notification and underreporting in Costa Rica, especially in humans and bovines. The seroprevalence of brucellosis and associated risk factors were determined in people who live or work in dairy farms that tested positive to bovine brucellosis in the Health Areas of Aguas Zarcas and Los Chiles, Alajuela, between 2015 and 2017, using an analytical cross-sectional study. Blood samples were collected from the subjects studied, and a survey was applied upon their informed consent. Samples were analyzed in parallel using the Rose Bengal and serum agglutination test (SAT). Descriptive statistics were conducted with the personal, cultural, and environmental factors associated with the risk for brucellosis. In addition, to determine factors associated with their serological status, odds ratios were estimated using unconditional logistic regression. Seroprevalence for smooth Brucella spp. was 12.5%. The preparation of food with unpasteurized milk products (OR = 11.0, 95% CI: 3.0-39.9), artificial insemination without adequate protection (OR = 8.84, 95% CI: 1.8-43.5), calving without basic protection (OR = 3.9, 95% CI: 1.1-14.1), and the consumption of homemade ice cream made with unpasteurized milk (OR = 7.9, 95% CI: 2.7-22.6) represented the main risk factors. Other factors showed a tendency to risk; however, the low amount of samples may have affected the statistical power of the estimates. An important exposure to smooth Brucella spp. is detected in the people that work and live on cattle farms with animals that tested positive to Brucella abortus, due to the execution of risky cultural practices. The quantitative difference between the cases reported to the epidemiological surveillance system of the Ministry of Health and the results of this study indicate that this disease should be included as a differential diagnosis for cases of acute febrile illness, and that an effective and efficient epidemiological surveillance system should be implemented.
Keywords: Public health, epidemiology, risk factors, epidemiological surveillance, zoonoses, One Health.
Resumo
A brucelose é uma doença zoonótica causada por espécies do gênero Brucella spp., com baixa notificação e subregistro na Costa Rica, especialmente em pessoas e em bovinos. Neste estudo foi determinada a soroprevalência para Brucella spp. lisas e fatores de risco associados, em pessoas que vivem ou trabalham em fazendas de gado positivas para a brucelose bovina das Áreas Reitoras da Saúde de Aguas Zarcas e Los Chiles, Alajuela, entre 2015 e 2017, por meio de um estudo transversal analítico. Uma amostra de sangue foi coletada das pessoas estudadas e uma pesquisa foi aplicada, com consentimento prévio e informado. As amostras foram analisadas, em paralelo, por meio dos testes de Rosa Bengala e seroaglutinação (SAT). Foram realizadas estatísticas descritivas de fatores pessoais, culturais e ambientais, associados ao risco de brucelose. Além disso, as razões de chances (Odds ratio) foram estimadas usando regressão logística não condicional para determinar os fatores associados ao seu estado sorológico. A soroprevalência para Brucella spp. lisa foi de 12,5%. A produção de alimentos com produtos lácteos não pasteurizados (OR = 11,0; IC95%: 3,0-39,9), a inseminação artificial sem proteção adequada (OR = 8,84; IC95%: 1,8-43,5), a assistência ao parto sem proteção básica (OR = ٣,٩; IC٩٥٪: ١,١-١٤,١) e o consumo de sorvete caseiro fabricado a partir de leite não pasteurizada (OR = 7,9; IC95%: 2,7-22,6), representaram os principais fatores de risco. Outros fatores mostraram uma tendência ao risco, mas é possível que o baixo número de amostras tenha afetado o poder estatístico das estimativas. Este estudo demonstrou uma importante exposição à Brucella spp. lisa em quem trabalha e vive em fazendas de gado com animais sororreativos à Brucella abortus, pelo desempenho de práticas culturais de risco. A diferença quantitativa entre os casos notificados ao sistema de vigilância epidemiológica do Ministério da Saúde (Minsa 2015; Minsa 2016), com os resultados deste estudo, indica que se deve reforçar a inclusão dessa doença como diagnóstico diferencial para casos de doença febril aguda, e instaurar um sistema de vigilância epidemiológica eficaz e eficiente.
Palavras-chave: Saúde pública, epidemiologia, fatores de risco, vigilância epidemiológica, zoonose, Uma Saúde.
La brucelosis es una enfermedad infectocontagiosa y zoonótica, de distribución mundial, causada por varias especies de Brucella spp (Corbel 2006; Pappas et al. 2006; Moreno 2014). La bacteria infecta células del sistema fagocítico mononuclear (Pessegueiro et al. 2003). Los síntomas de la infección, en humanos, son variados, desde fiebres ondulantes hasta endocarditis o complicaciones neurológicas (Villalobos-Zúñiga et al. 2011; Dean et al. 2012a).
La brucelosis en bovinos, ovinos, caprinos, perros y cetáceos, es de distribución mundial y muy pocos países no la presentan. Algunos países del mediterráneo como: España, Italia y Portugal son considerados oficialmente libres de B. mellitensis; igualmente, Australia y Nueva Zelanda, en Oceanía, se consideran libres de brucelosis por B. abortus y B. mellitensis (Coelho et al. 2014).
Esta infección continúa siendo un importante problema de salud pública en muchos países del mundo. Recientemente, se ha descrito 9 especies del género Brucella, de las cuales: B. abortus, B. suis, B. melitensis y, raramente B. canis, son las más comúnmente asociadas con enfermedades humanas (Whatmore et al. 2014; Scholz et al. 2016). Por mucho tiempo, se ha reportado cerca de 500,000 nuevos casos humanos por año, en el mundo, considerando las infecciones por todas las especies de Brucella (Corbel 2006; Pappas et al. 2006); sin embargo, nuevas estimaciones indican hasta 12.5 millones de nuevos casos (Hull & Schumaker 2018; Berger 2019). Inclusive, los nuevos casos en Europa alcanzan cerca de 500 por año, siendo los países del este los más afectados (ECDC 2016). Sin embargo, intentos por cuantificar la carga de enfermedad por esta infección han tenido pobres resultados debido a sistemas de vigilancia débiles con una alta subestimación de su incidencia y de sus efectos (Dean et al. 2012b).
Por ello, dentro del enfoque de Una Salud (One Health), impulsado por la Organización Mundial de la Salud (OMS), en conjunto con la Organización de las Naciones Unidas para la Alimentación (FAO) y la Organización Mundial de Sanidad Animal (OIE), zoonosis, como la brucelosis, son ampliamente estudiadas (CDC 2019; WHO 2019); aunque desde mucho antes se ha insistido en la importancia del estudio de las zoonosis y sus determinantes (Matamoros et al. 2000).
El grado de prevalencia de la infección animal, el nivel socioeconómico y los hábitos alimenticios, afectan directamente la incidencia en los humanos (Ariza 1989; Young 1995; Pappas et al. 2006). Las personas, según el riesgo de entrar en contacto con las secreciones de ovinos, caprinos, bovinos y caninos infectados con Brucella spp., entre otros, tienen la posibilidad de adquirir la brucelosis. Se puede clasificar ese riesgo en dos grupos: los de bajo riesgo, la población en general y los de alto riesgo, las personas que están en contacto frecuente con las secreciones de los animales o sus productos (Hernández 2005; Molineri et al. 2013; Tarabla 2017).
Al respecto, existe amplia evidencia de que las causas más comunes de infección han sido las condiciones laborales relacionadas con los profesionales de ganado expuestos (veterinarios, trabajadores de mataderos y criadores de animales) y el consumo de productos infectados (carne, leche y productos lácteos) (Swai & Schooman 2009; Yoo et al. 2009; Mufinda et al. 2017; Acharya et al. 2018).
Las vías, por las cuales se infectan las personas con Brucella spp, son: ingestión, el contacto directo con las secreciones, la inhalación y la inoculación accidental; para los de alto riesgo. La vía es el contacto directo con productos de aborto que contiene millones de bacterias entrando al cuerpo humano a través de la conjuntiva o la piel con lesiones. Además del contacto con vísceras, sangre y excretas de animales enfermos; igualmente, se relaciona con la ocupación del individuo la vía respiratoria pues la infección se da por inhalación de materiales desecados contaminados con excretas, pelo y polvo de corrales, o por suspensiones de Brucella spp vivas en el laboratorio. Para la población en general, la vía oral contribuye con la diseminación de la enfermedad por el consumo de alimentos contaminados con la bacteria Brucella spp (Hernández 2005).
En Costa Rica, la brucelosis, es una enfermedad de notificación obligatoria, tanto en personas como en animales. Entre el 2015 y el 2017, la Caja Costarricense de Seguro Social (CCSS) reporta 144 pacientes que cumplieron con la definición de caso (Castro 2019) en todo el país, y únicamente ocho en la Región Huetar Norte. Por su parte, el Servicio Nacional de Salud Animal (SENASA), sólo para el 2017, reporta 1475 casos en bovinos, distribuidos en toda Costa Rica, de los cuales 705 diagnosticados en la Región Huetar Norte (SENASA 2017). Esta situación crea dudas en la prevalencia de la enfermedad, en personas, en esta región. Por otra parte, en un estudio realizado en los distritos de Potrero Cerrado y Santa Rosa, del Cantón de Oreamuno de Cartago, se detecta, en personas, una seroprevalencia menor al 1%; en ninguno de los casos se trata de una infección activa (Chanto et al. 2007).
Debido a la gravedad que puede llegar a provocar la enfermedad en las personas, y a la ausencia de datos epidemiológicos, este estudio se propone determinar la seroprevalencia de la brucelosis y sus factores de riesgo, en las personas que habitan o trabajan en las fincas ganaderas positivas por brucelosis bovina, ubicadas en las Áreas Rectoras de Salud de Aguas Zarcas y Los Chiles, provincia de Alajuela, Costa Rica, durante 2015 a 2017.
Materiales y Métodos
Tipo de estudio, variables y población analizada
En las Áreas Rectoras de Salud de Aguas Zarcas y Los Chiles, se realiza un estudio transversal, de prevalencia y analítico. Se incluye a las personas que habitaban o trabajaban en las fincas ganaderas con reactores positivos a brucelosis bovina en los tres años (2015 al 2017) previos al período de estudio. Se excluye a las personas que no son habitantes o trabajadores permanentes de la finca, o cuya relación con la finca no fuera constante; por ejemplo, trabajadores ocasionales o personas que llegan de visita en forma temporal. Igualmente, se excluye, a quienes se regala o vende productos lácteos, quienes no pertenecen al grupo familiar que habita la vivienda. Asimismo, se deja por fuera a trabajadores que ingresan a la finca posterior a la fecha en que el SENASA declara libre de brucelosis esa finca ganadera. Finalmente, no se toma en cuenta a las personas con menos de dos meses de vivir o trabajar en la finca.
El estudio se realiza durante noviembre 2017 y marzo del 2018. En una fase previa, con el propósito de explicar el objetivo del trabajo, dar a conocer la ficha de tamizaje y el consentimiento informado, se realiza una reunión con los profesionales de salud de la CCSS de las Áreas de Salud de Los Chiles y Aguas Zarcas. Además, se realiza una reunión en cada una de las fincas involucradas, en las cuales se explica el objetivo del estudio, haciendo especial énfasis en el consentimiento informado. Se detalla todo lo relacionado con la enfermedad y se evacua las consultas al respecto. Hasta no haber cumplido con esta fase, a cabalidad, no se pide la firma del consentimiento.
Por ser un estudio observacional, el cual forma parte de las funciones propias de los profesionales del Ministerio de Salud, se prescinde del aval de un Comité Ético Científico, tal como lo expresa el Artículo 7 de la Ley Reguladora de Investigación Biomédica, N° 9234 (Asamblea Legislativa de la República de Costa Rica 2014).

Toma, transporte y manejo de la muestra sanguínea
Se toma la muestra, mediante flebotomía, de la vena cubital o la cefálica. Se sigue el protocolo establecido, haciendo especial énfasis en el uso de materiales estériles. La correcta desinfección del área de punción, las medidas de bioseguridad de quien toma la muestra, así como la seguridad del paciente.
Se utiliza tubos al vacío, del sistema Vacutainer®, previamente rotulados con el nombre del paciente; luego son colocados en una gradilla, dentro de una hielera, con una temperatura entre 2 y 8 °C, para ser transportadas al Laboratorio. Ahí, se separa el suero, mediante centrifugación a 1500 rpm, durante 10 minutos. Las muestras se congelan a -20° Celsius hasta su traslado al Laboratorio del Centro Nacional de Referencia en Bacteriología (CNR-Bacteriología) del Instituto Costarricense de Investigación y Enseñanza en Nutrición y Salud (INCIENSA). Es el laboratorio nacional de referencia, para el diagnóstico laboratorial.
Diagnóstico laboratorial
Las muestras son analizadas, en el CNR-Bacteriología del Inciensa, mediante la técnica de Aglutinación de Rosa Bengala (RBT), tanto en aglutinación en lámina como en microaglutinación (Díaz & Moriyón 1989), de la marca IDEXX (Montpellier, Francia) a una concentración de 1:100 (en PBS 7,2 – 7,4), para la microaglutinación y 1:4 (en buffer de lactato pH 3,6) para la aglutinación en lámina. Asimismo, se realiza el Test serológico de aglutinación en microplaca (SAT, Serum Agglutination Test) (Alton et al. 1988). Para esta última, se considera un título ≥ 1:80 como significativo de exposición previa a B. abortus, B. suis o B. melitensis. Además, los sueros se analizan con la técnica de microaglutinación en placa más mercaptoetanol (SAT-mercaptoetanol).
Estas pruebas poseen alta sensibilidad, son fáciles y rápidas, así como de bajo costo (Serra & Viñas 2004; Nielsen & Yu 2010), lo cual permite que muchos sistemas de vigilancia las utilicen como pruebas diagnósticas de elección para brucelosis humanas por cepas lisas.
A las personas positivas no se realiza el hemocultivo, pues no se establece en el consentimiento informado. Sí se traslada el dato de las personas, con resultado positivo, al personal de la CCSS para su seguimiento médico.
Origen, captura y edición de datos
A cada persona incluida se aplica un cuestionario, creado específicamente para esta investigación, validado mediante la aplicación a 8 personas de la población blanco. Esos cuestionarios se revisan en aspectos de comprensión del lenguaje aplicado, de la consistencia de las repuestas y de la extensión en tiempo.
Los cuestionarios, en físico, son revisados para verificar su completitud, por duplicado, por parte de dos investigadores. Posteriormente, los datos son trasladados a una hoja de Excel (Microsoft Office), y se agrega los resultados de los análisis del laboratorio.
Durante la depuración de los datos, no hubo eliminación de alguno. Todos los casos cumplían con los criterios de inclusión para el estudio.
Análisis de datos
En una primera fase, se efectúa un análisis univariado, descriptivo, mediante el cálculo de las medidas de tendencia central (media y mediana) y de dispersión (desviación estándar) de las variables continuas, así como las frecuencias absolutas y relativas (porcentajes) de las variables discretas. Posteriormente, se realiza pruebas de diferencias de promedios, mediante pruebas de T de Student o Anova, así como pruebas de diferencia de porcentajes. Se utiliza las pruebas de Chi-cuadrado exacta de Fisher y mediante solución de continuidad de Yates (Daniel 2002). Se utiliza el valor p < 0,05 para expresar significancia estadística.
Para determinar la asociación epidemiológica con el estatus serológico a Brucella spp., se calcula las razones de posibilidades (OR por su nombre en inglés Odds Ratio), con sus respectivos intervalos de confianza al 95%, mediante regresión logística, en dos fases. La primera consiste en un análisis bivariado, para todas variables de exposición. No hay una variable de exposición principal. En la segunda fase, las variables que presentan un valor de p<0.25, ingresan al análisis multivariado, en una estrategia, paso a paso, hacia adelante, según su fuerza de asociación (valor de la significancia) resultante en el análisis bivariado. En el proceso de modelaje, se excluye aquellas con valores de p < 0.05. La razón de verosimilitud (likelihood ratio) es el estadístico de prueba, utilizado para establecer el grado de ajuste entre un modelo y el anterior, hasta dejar el de mejor ajuste.
Resultados
Se investiga un total de 144 personas, a las cuales se toma la respectiva muestra sanguínea, en ambas Áreas Rectoras: Los Chiles y Aguas Zarcas. El 12.5% (n=10) de las personas resultan positivo a Brucella spp. Mayor la seroprevalencia en hombres, (14.1%), que en mujeres (10.2%), aunque no es significativa (Cuadro 2).
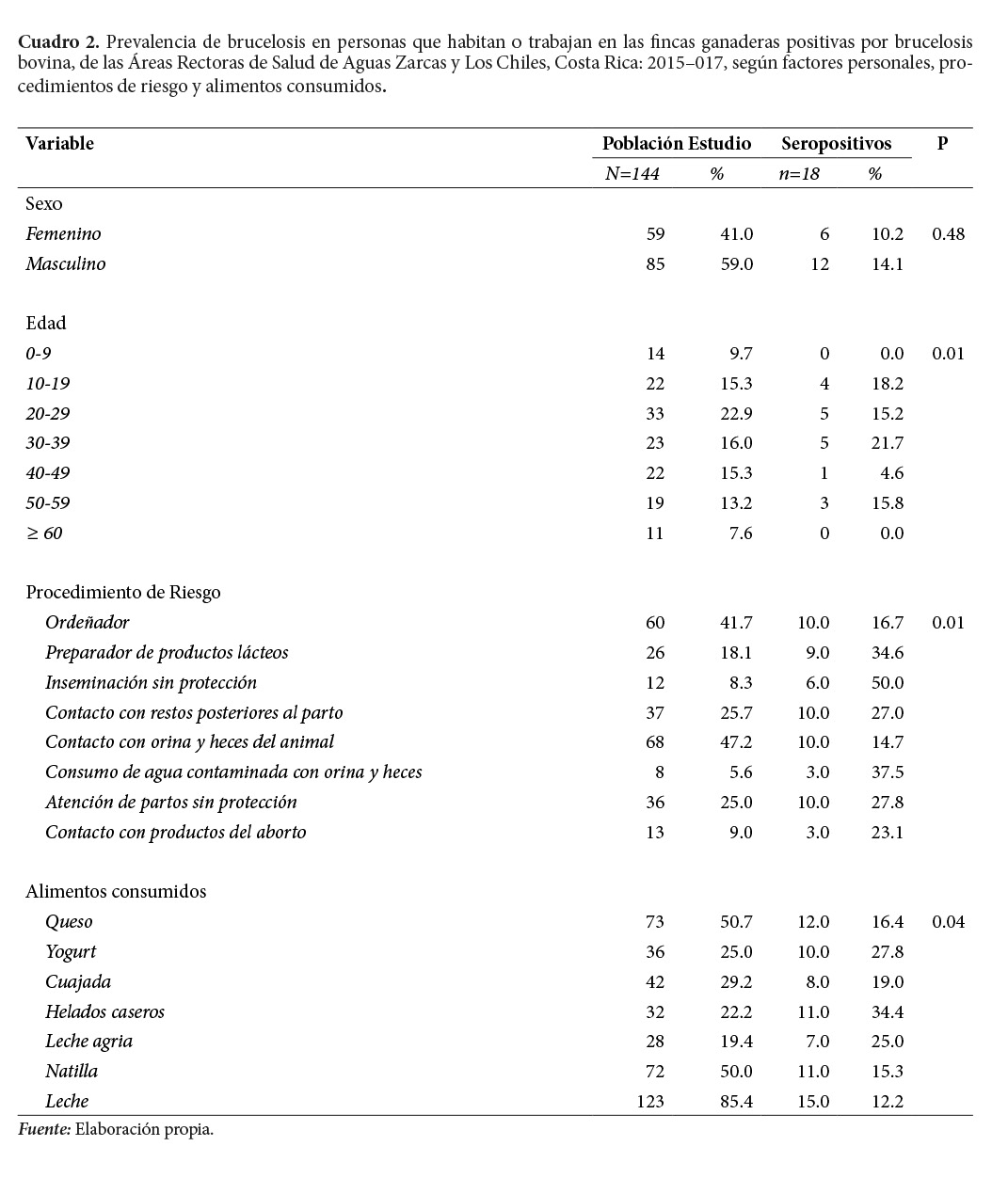
Dentro de los procedimientos de riesgo, la inseminación artificial, sin protección adecuada del inseminador, (guantes, delantal impermeable, botas de hule), presenta la mayor prevalencia (50%), seguido del consumo de agua, posiblemente contaminada con orina, heces y otras secreciones de los animales (37.5%); la preparación de productos lácteos, como quesos, (34.6%). No se presenta diferencia significativa entre esas prácticas y las relacionadas con la atención del parto o el contacto con materiales del aborto (Cuadro 2).
Específicamente, en el grupo de los seropositivos, el 83.3% (15/18) de la población seropositiva consume leche sin pasteurizar; el 66.60% (12/18) queso artesanal. Respecto a las actividades de riesgo, el 55% (10/18) tuvo contacto con fluidos de bovinos o con restos posteriores al parto, ordeñaba o atendía el parto sin protección alguna, tal como guantes, botas de hule, delantal impermeable, mascarilla y anteojos (Cuadro 2).
En el Cuadro 2, se observa cómo las personas que consumen helados caseros, yogurt y leche agria sin pasteurizar, son quienes presentan las mayores prevalencias.
Al análisis (bivariado), sin ajustar las variables de procedimientos de riesgo realizados por las personas estudiadas, quien es ordeñador o tiene contacto con el aborto o sus productos, resulta no estar asociado con la condición de seropositivo a Brucella spp. Las variables con el riesgo son: la inseminación artificial, sin protección adecuada, y la preparación de productos lácteos, como queso, seguido del contacto con restos del parto, la atención de partos y el consumo de agua contaminada (Cuadro 3).

Por otra parte, respecto al consumo de productos lácteos, únicamente el consumo de helados caseros, yogurt y leche agria sin pasteurizar, son asociados con la seropositividad a la bacteria, en el análisis no ajustado (Cuadro 4).
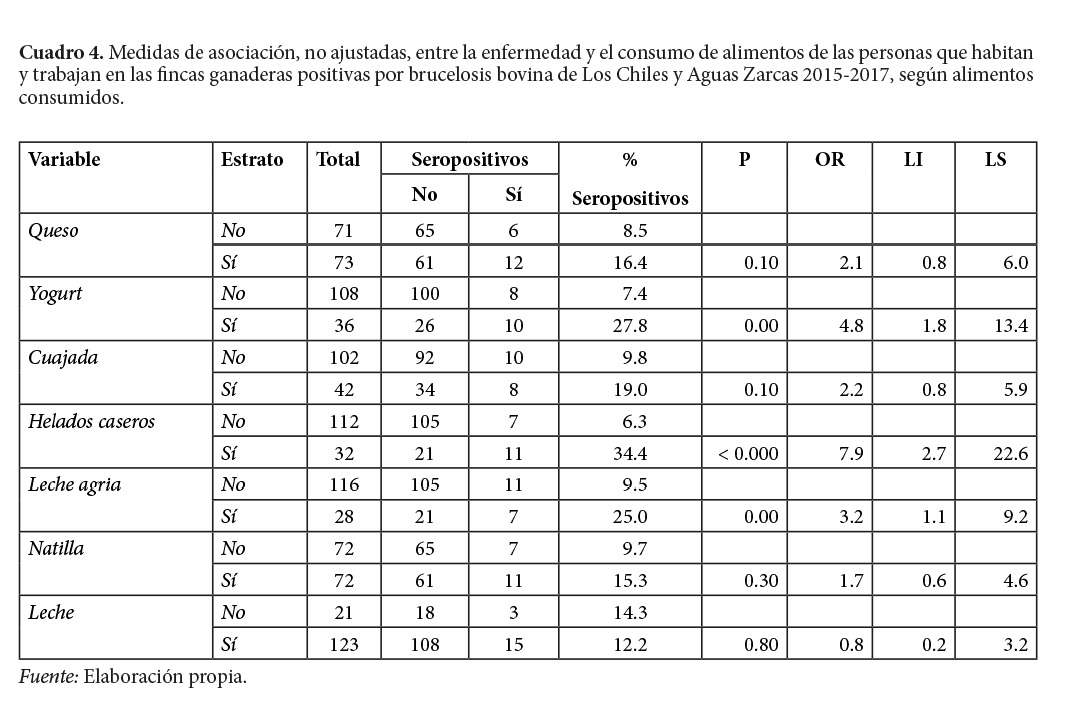
De las cinco variables con asociación estadísticamente significativa, en el análisis bivariado, para prácticas de riesgo (Cuadro 3), así como las de consumo de alimentos lácteos (Cuadro 4), resulta explicativas, una vez ajustadas en el modelo multivariado el hecho de elaborar alimentos con: productos lácteos tales como quesos no pasteurizados, la inseminación artificial sin protección adecuada y la atención de partos sin indumentaria básica de protección; asimismo, de los alimentos de riesgo, únicamente el consumo de helados caseros representa riesgo (Cuadro 5).

Discusión
El estudio permite determinar, en personas que trabajan o viven en fincas ganaderas bovinas de las áreas geográficas adscritas a las Áreas Rectoras de Salud, del Ministerio de Salud de Costa Rica, de Los Chiles y Aguas Zarcas, un elevado porcentaje de personas seropositivas por exposición previa a Brucella spp. lisas. Son pocos los estudios con muestras poblacionales humanas que puedan servir como referencia; más bien, los datos que se obtiene para Costa Rica se desprenden de los registros de la CCSS, del Ministerio de Salud o del Inciensa. Chanto et al. (2007), en un estudio de 714 pobladores de Potrero Cerrado y Santa Rosa, del cantón de Oreamuno, Cartago, población considerada de riesgo aumentado por estar expuestos al contacto con bovinos y sus secreciones, así como los subproductos de la leche, encuentran 0,87% de personas seropositivas, lo cual contrasta con los resultados de este estudio.
Esta enfermedad, hasta el momento -aparentemente- subregistrada en Costa Rica, muestra, en esta población con una condición especial de riesgo por estar en mayor contacto con animales de fincas positivas a Brucella abortus y sus secreciones, un porcentaje mayor a la media poblacional que, entre el 2015 y el 2017, según datos de la CCSS, diagnostica ocho casos que cumplen con la definición de caso en la Región Huetar Norte y 144 en el país (Castro 2019).
La ausencia de un protocolo específico para la vigilancia epidemiológica de la brucelosis en Costa Rica hace que no haya un dato consolidado de los casos que se presentan en el país; por ello, los datos del Inciensa, del Ministerio de Salud y de la CCSS no son coincidentes en algunos momentos, inclusive en años completos. Aún más, no existe, en alguno de los tres entes, un sitio público de fácil acceso, como un sitio en internet, en que se pueda acceder el dato oficial actualizado.
Es probable que la diferencia, entre lo notificado al Ministerio de Salud y lo obtenido en este estudio, por medio de pruebas indirectas de historia previa de infección con la bacteria, se deba a que muchos casos de brucelosis transcurren de forma subclínica o, porque en la mayoría de las veces, se confunde con una gripe o cuadros febriles inespecíficos. Según Young (1995) y Chanto et al. (2007). La brucelosis es una enfermedad de síntomas inespecíficos; pueden aparecer a partir de dos o tres semanas después de la infección. Esto concuerda con lo referido por los encuestados en este estudio, pues los síntomas característicos de la enfermedad, referidos por ellos, no tienen relación con su estatus serológico para brucelosis.
En Colombia, el subregistro está relacionado con la carencia de formación de los médicos en temas de medicina del trabajo. El escaso nivel de información de los trabajadores con respecto a los riesgos ocupacionales y el poco desarrollo de los programas de salud ocupacional en las empresas (Gómez et al. 2001). Este factor contribuye, fuertemente, al silencio epidemiológico que ha caracterizado a las zoonosis, aún en zonas endémicas. Sin embargo, en países como México, se han incrementado los casos por el aumento en el reporte y sistemas de notificación (Cárdenas 2000).
Así, los hallazgos de este estudio, de una seroprevalencia que supera el 10%, a pesar de ser en población de un riesgo aumentado por su exposición a los bovinos y sus secreciones, debe alertar, al menos en estas Áreas Rectoras de Salud que, dado que la enfermedad se puede confundir con muchas otras enfermedades febriles y que, por estar en una zona ganadera endémica a brucelosis (Hernández-Mora et al. 2017), esta enfermedad debe ser tomada en consideración, con mucho mayor frecuencia y diligencia, dentro de los diagnósticos diferenciales para evitar el riesgo de consecuencias severas en los pacientes a causa de esta enfermedad.
Es claro que no es posible inferir que la seroprevalencia detectada en este estudio sea la que se pueda -o deba- encontrar en otras zonas ganaderas con similares condiciones de riesgo por la relación con los animales y sus secreciones, las prácticas culturales de riesgo en el trabajo o por el consumo de productos lácteos. Ejemplo de esto es el estudio de Chanto et al. (2007) previamente citado.
La relación entre la seropositividad y los factores de riesgo, encontrados en esta población particular, se explica en prácticas culturales heredadas, especialmente el trabajo directamente con los bovinos sin usar protección alguna, así como el consumo de lácteos sin pasteurizar. Estos resultados coinciden fuertemente con los de Chanto et al. (2007) y Ron-Román et al. (2014), quienes, en distintos estudios, el primero en Costa Rica, el segundo en Ecuador, muestran que el hecho de pertenecer al grupo de personas de alto potencial de riesgo ocupacional, el contacto con los animales y con secreciones fetales, así como el consumo de leche sin pasteurizar, constituyen factores de riesgo asociados a la infección de los humanos por la enfermedad.
Respecto a este último factor, el consumo de lácteos no pasteurizados continúa siendo una de las principales causas de infección (Swai & Schooman 2009; Yoo et al. 2009; Cavalcanti et al. 2015; Mufinda et al. 2017; Acharya et al. 2018). A pesar de que, en el área de estudio, la práctica de consumir productos lácteos sin pasteurizar es muy frecuente y es un importante factor de riesgo, se considera importante hacer notar que el consumo de leche, que se esperaba fuera un factor de riesgo, no lo es (Cavalcanti et al. 2015). Esto se explica en que, en los hogares de los encuestados, la leche suele ser hervida para el consumo en su forma fluida, más no para la producción de quesos artesanales, helados, yogurt u otros.
Por otra parte, se ha documentado, ampliamente, que las personas vinculadas a la práctica de la ganadería, en las localidades estudiadas, presentan un alto riesgo de padecer la enfermedad, por el hecho de pertenecer al grupo de los que están expuestos a factores de riesgo ocupacional (Hernández 2005; Molinieri et al. 2013; Méndez-Lozano et al. 2015; Tarabla 2017).
Es fundamental comprender que, sin brucelosis animal, no existe enfermedad en el hombre. Por ello, se debe poner énfasis en la implementación y difusión de medidas tendientes a controlar y erradicar esta enfermedad en los animales (Trabattoni et al. 2004; Zinsstag et al. 2007). Por consiguiente, se insiste en que la prevención de la brucelosis humana depende del control de la enfermedad en los animales, situación que justifica la búsqueda de otras especies de Brucella spp, en población animal susceptible, dado que esta zoonosis involucra un amplio grupo de reservorios animales.
Conclusiones
La población adscrita a las Áreas Rectoras de Salud de Aguas Zarcas y Los Chiles, en la provincia de Alajuela, tienen una importante exposición a la Brucella spp., especialmente quienes laboran y viven en fincas de ganado bovino, particularmente por la realización de una serie de prácticas culturales de riesgo, de tipo laboral, así como por la ingesta de productos lácteos no pasteurizados. Al demostrar una amplia diferencia cuantitativa entre los casos notificados al sistema de vigilancia epidemiológica del Ministerio de Salud, con los resultados de este estudio, se recomienda, de manera vehemente, que se protocolice la vigilancia de esta enfermedad y que se incluya, con mayor fuerza y frecuencia, como diagnóstico diferencial para casos de enfermedad febril aguda, especialmente en regiones y en población de mayor riesgo por su probable exposición.
El sistema institucional de laboratorios de la CCSS, en los hospitales de todo el país, con el apoyo del Laboratorio Nacional de Referencia en el Inciensa, permite un diagnóstico expedito y oportuno de los casos para su atención médica, así como la investigación epidemiológica en colaboración con los equipos locales del Ministerio de Salud y del SENASA.
Toda esta labor de vigilancia de la brucelosis humana requerirá de sensibilizar a la población general, a la comunidad médica y al sector empresarial, sobre esta enfermedad y su importancia; pero se debe empezar por el mismo Ministerio de Salud y la Caja Costarricense de Seguro Social, para que diseñen y pongan en práctica un real sistema de vigilancia epidemiológica, con su propio protocolo, en coordinación con el Servicio Nacional de Salud Animal, para una detección eficaz y oportuna de los casos.
Agradecimientos
Este estudio se realiza con el apoyo de la Caja Costarricense de Seguro Social (CCSS) en la persona de la Dra. Hazel Mairena del Hospital Los Chiles y la CILOVE del Área de Salud Aguas Zarcas; del Instituto Nacional de Investigación y Enseñanza en Nutrición y Salud (INCIENSA) por medio de la Dra. Grettel Chanto, la Dra. Diana Chinchilla y la Dra. Hilda Bolaños; así como del Ministerio de Salud y del Servicio Nacional de Salud Animal (SENASA).
Conflicto de interés
Los autores declaran no tener conflicto de intereses.
Referencias
Acharya, D., Hwang, S.D., & Park, J.H. 2018. Seroreactivity and Risk Factors Associated with Human Brucellosis among Cattle Slaughterhouse Workers in South Korea. Int. J. Environ. Res. Public Health. 15(11). doi: 10.3390/ijerph15112396.
Alton, G.G., Jones, L.M., Angus, R.D., & Verger, J.M., 1988. Techniques for the Brucellosis Laboratory. Institut National de la Recherche Agronomique (INRA), Paris. p. 190.
Ariza, C.J. 1989. Brucelosis: algunos aspectos de su epidemiologia. Enf. Infecc. Microbiol. Clin. 7(10): 517–518.
Asamblea Legislativa de la República de Costa Rica. Ley Reguladora de la Investigación Biomédica. (Ley 9234). La Gaceta Nº 79. 25 de abril del 2014.
Berger, S. 2019. Brucellosis: Global Status. GIDEON Informatics, Inc., Los Ángeles.
Cárdenas, J.A. 2000. Situación en Colombia y Latinoamérica de las zoonosis. Revista MVZ Córdoba 5(1): 41–45. doi: 10.21897/rmvz.540
Castro, J. 2019. Perfil Epidemiológico de la Brucelosis Humana en Costa Rica, 2015 al 2018. IV Jornada de Epidemiología, Región Brunca, 16-18 de octubre 2019. https://jornadaepidemiolog.wixsite.com/save/presentaciones-modalidad-oral (Accedido 22 octubre 2019).
Cavalcanti, C.P.O., Almeida, J.A., Feitosa, A., Firmino, S., Andrade, M.V., & da Silva-Júnior, F.F. 2015. Prevalence of Brucella spp. in humans. Rev. Latino-Am. Enfermagem 23(5): 919–926. doi: 10.1590/0104-1169.0350.2632
CDC (Centers for Disease Control and Prevention). 2019. One health. https://www.cdc.gov/onehealth/index.html. (Accedido 15 octubre 2018).
Chanto, G., Rojas, N., Ching, A., Zúñiga, R., Castro, E., Chaverri, S., Asenjo, A., & Campos, E. 2007. Prevalencia de anticuerpos séricos contra la bacteria Brucella sp. en una población humana tropical. Rev. Biol. Trop. 55(2): 385–391. doi: 10.15517/rbt.v55i2.6018
Coelho, A., Díez, J.G., & Coelho, A.C. 2014. Brucelosis en pequeños rumiantes: etiológia, epidemiología, sintomatología, diagnóstico, prevención y control. Rev. Electrón. Vet. 15(5) : 1-31.
Corbel, M.J. 2006. Brucellosis in humans and animals. World Health Organization, Suiza. https://www.who.int/csr/resources/publications/Brucellosis.pdf (Accedido 15 octubre 2018).
Daniel, W. 2002. Bioestadística: Base para el análisis en ciencias de la salud, 4a Edición. Limusa-Wiley, México D.F. p. 1-923.
Dean, A.S., Crump, L., Greter, H., Hattendorf, J., Schelling, E., & Zinsstag, J. 2012(a). Clinical manifestations of human brucellosis: a systematic review and meta-analysis. PLOS Negl. Trop. D. 6(12): e1929. doi: 10.1371/journal.pntd.0001929.
Dean, A.S., Crump, L., Greter, H., Schelling, E., & Zinsstag, J. 2012(b). Global burden of human brucellosis: a systematic review of disease frequency. PLOS Negl. Trop. D. 6(10):e1865. doi: 10.1371/journal.pntd.0001865.
Díaz, R., & Moriyón, I. 1989. Laboratory techniques in the diagnosis of human brucellosis. In: Young, E.J. & Corbel, M.J. (Eds.). Brucellosis: Clinical and laboratory aspects of human infection. CRC Press Inc., Florida. p 73–83.
ECDC (European Centre for Disease Control). 2017. Annual Epidemiological Report on Communicable Diseases in Europe. https://ecdc.europa.eu/en/publications-data/brucellosis-annual-epidemiological-report-2016-2014-data (Accedido 15 octubre 2018).
Gómez, C.N., Sanclemente, J.H., & Manosalva, W.A. 2001. Determinación de seroprevalencia para brucelosis en los trabajadores pecuarios, de mataderos y expendedores de carne en el Departamento de Arauca. Universidad Jorge Tadeo Lozano, Bogotá.
Hernández, E. 2005. Seropositividad y factores de riesgo de brucelosis humana en el ejido de San Rafael de Martínez, Mier y Noriega, NL 2004. Tesis para obtener el grado de Maestría en Salud Pública. Universidad Autónoma de San Luis Potosí, Ciudad de México. https://ninive.uaslp.mx/xmlui/bitstream/handle/i/2997/MSP1SFR00501.pdf?sequence=6&isAllowed=y (Accedido15 octubre 2018).
Hernández-Mora, G., Ruiz-Villalobos, N., Bonilla-Montoya, R., Romero-Zúñiga, J.J., Jiménez-Arias, J., González-Barrientos, R., Barquero-Calvo, E., Chacón-Díaz, C., Rojas, N., Chaves-Olarte, E., Guzmán-Verri, C., & Moreno, E. 2017. Epidemiology of bovine brucellosis in Costa Rica: Lessons learned from failures in the control of the disease. PLOS One 12(8): e0182380. doi: 10.1371/journal.pone.0182380.
Hull, N.C., & Schumaker, B.A. 2018. Comparisons of brucellosis between human and veterinary medicine. Infect. Ecol. Epidemiol. 8(1): 1500846. doi: 10.1080/20008686.2018.1500846
Matamoros, J.A., Sanín, L.H., & Santillana, M.A. 2000. Las zoonosis y sus determinantes sociales: una perspectiva a considerar en salud pública. Rev. Salud Pública 2(1): 17–35.
Méndez-Lozano, M., Rodríguez-Reyes, E.J., & Sánchez-Zamorano, L.M. 2015. Brucellosis, a zoonotic disease present in the population: A time series study in Mexico. Salud Pública Mex. 57 (6): 519-527.
Ministerio de Salud. 2015. Boletín Estadístico de Enfermedades de Declaración Obligatoria en Costa Rica del año 2014. https://www.ministeriodesalud.go.cr/index.php/vigilancia-de-la-salud/estadisticas-y-bases-de-datos/notificacion-colectiva/2783-boletin-registro-colectivo-2014/file (Accedido 12 marzo 2018).
Ministerio de Salud. 2016. Boletín Estadístico de Enfermedades de Declaración Obligatoria en Costa Rica del año 2015. https://www.ministeriodesalud.go.cr/index.php/vigilancia-de-la-salud/estadisticas-y-bases-de-datos/notificacion-individual/3167-boletin-de-morbilidad-enfermedades-de-declaracion-obligatoria-2015-2/file (Accedido 12 marzo 2018).
Molineri, A., Signorini, M.L., Pérez, L., & Tarabla, H.D. 2013. Zoonoses in rural veterinarians in the central area of Argentina. Aust. J. Rural Health 21(5): 285-290. doi: 10.1111/ajr.12054
Moreno, E. 2014. Retrospective and prospective perspectives on zoonotic brucellosis. Front. Microbiol. 5: 1-18. doi: 10.3389/fmicb.2014.00213
Mufinda, F.C., Boinas, F., & Nunes, C. 2017. Prevalence and factors associated with human brucellosis in livestock professionals. Rev. Saúde Pública 57: 1-10. doi: 10.1590/S1518-8787.2017051006051
Nielsen, K., & Yu, W.L. 2010. Serological diagnosis of brucellosis. Prilozi 31(1): 65-89. doi: 616.98:579.841.93.083.33.
Pappas, G., Papadimitriou, P., Akritidis, N., Christou, L., & Tsianos, E.V. 2006. The new global map of human brucellosis. Lancet Infect. Dis. 6(2):91-99. doi: 10.1016/S1473-3099(06)70382-6
Pessegueiro, P., Barata, C., & Correia, J. 2003. Brucelose – uma revisão sistematizada. Medicina Interna 10(2): 91–100.
Ron-Román, J., Ron-Garrido, L., Abatih, E., Celi-Erazo, M., Vizcaíno-Ordóñez, L., Calva-Pacheco, J., González-Andrade, P., Berkvens, D., Benítez-Ortiz, W., Brandt, J., Fretin, D., & Saegerman, C. 2014. Human brucellosis in northwest Ecuador: typifying Brucella spp., seroprevalence, and associated risk factors. Vector Borne Zoonotic Dis. 14(2): 124–133. doi: 10.1089/vbz.2012.1191
SENASA (Servicio Nacional de Salud Animal). 2017. Boletines epidemiológicos 2017. https://www.SENASA.go.cr/informacion/centro-de-informacion/informacion/estado-sanitario/boletines-epidemiologicos. (Accedido 22 octubre 2019).
Serra, J., & Viñas, M. 2004. Laboratory diagnosis of brucellosis in a rural endemic area in northeastern Spain. Int. Microbiol. 7(1): 53-58.
Scholz, H.C., Revilla-Fernández, S., Al Dahouk, S., Hammerl, J.A., Zygmunt, M.S., Cloeckaert, A., Koylass, M., Whatmore, A.M., Blom, J., Vergnaud, G., Witte, A., Aistleitner, K., & Hofer, E. 2016. Brucella vulpis sp. nov., isolated from mandibular lymph nodes of red foxes (Vulpes vulpes). Int. J. Syst. Evol. Microbiol. 66(5): 2090–2098. doi: 10.1099/ijsem.0.000998
Swai, E.S., & Schoonman, L. 2009. Human brucellosis: seroprevalence and risk factors related to high risk occupational groups in Tanga Municipality, Tanzania. Zoonoses Public Hlth. 56(4): 183–187. doi: 10.1111/j.1863-2378.2008.01175.x
Tarabla, H.D. 2017. Riesgos laborales en Medicina Veterinaria en América Latina y el Caribe. Revisión. Ciencias Veterinarias ٣٥(2): 65-84. doi: 10.15359/rcv.35-2.2
Trabattoni, E., Lavaroni, O., Vera, E., & García, N. 2004. Prevalencia de Brucelosis en Alumnos y Docentes de Ciencias Veterinarias de Esperanza en el Año 2002. FAVE Sección Ciencias Veterinarias 3(1-2): 25–31. Doi: 10.14409/favecv.v3i1/2.1402
Villalobos-Zúñiga, M.A., Barrantes-Valverde, E., & Monge-Ortega, P. 2011. Endocarditis por Brucella abortus: Reporte del primer caso en CR. Acta Med. Costarric. 53(3):154-157.
Whatmore, A.M., Davison, N., Cloeckaert, A., Al Dahouk, S.A., Zygmunt, S.M., Brew, S.D, Perrett, L.L., Koylass, M.S., Vergnaud, G., Quance, C., Scholz, H.C., Dick Jr, E.J., Hubbard, G., & Schlabritz-Loutsevitch, N.E. 2014. Brucella papionis sp. nov. isolated from baboons (Papio spp.). Int. J. Syst. Evol. Microbiol. 64 (12): 4120–4128. doi: 10.1099/ijs.0.065482-0
WHO (World Health Organization). 2019. One health. https://www.who.int/features/qa/one-health/en/. (Accedido 15 octubre 2018).
Yoo, S.J., Choi, Y.S., Lim, H.S., Lee, K., Park, M.Y., Chu, C., & Kang, Y.A. 2009. Seroprevalence and Risk Factors of Brucellosis among Slaughterhouse Workers in Korea. J. Prev. Med. Public Health 42(4): 237-242. doi: 10.3961/jpmph.2009.42.4.237
Young, E.J. 1995. An overview of human brucellosis. Clin. Infect. Dis. 21(2): 283–290. doi: 10.1093/clinids/21.2.283
Zinsstag, J. Schelling, E., Roth, F., Bonfoh, B., de Savigny, D., & Tanner, M. 2007. Human benefits of animal interventions for zoonosis control. Emerg. Infect. Dis. 13(4): 527–531. doi: 10.3201/eid1304.060381.